| صفات عامة | |
|---|---|
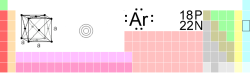
| الاسم، الرقم، الرمز | أرغون ، Ar ، 18 |
| سلاسل كيميائية | غاز نبيل |
| المجموعة، الدورة، المستوى الفرعي | p ، 3 ، 18 |
| المظهر | عديم اللون |
| كتلة ذرية | 39.948(1) غ/مول |
| شكل إلكتروني | [Ne] 3s2 3p6 |
| عدد الإلكترونات لكل مستوى | 2, 8, 8 |
| خواص فيزيائية | |
| الحالة | gas |
| كثافة | 0 °C, 101.325 kPa 1.784 g/L |
| نقطة الانصهار | 83.80 ك -189.35 م ° -308.83 ف ° |
| نقطة الغليان | 87.30 ك -185.85 م ° -302.53 ف ° |
| النقطة حرجة | 150.87 K, 4.898 MPa |
| حرارة الانصهار | 1.18 كيلو جول لكل مول |
| حرارة التبخر | kJ/mol 6.43 |
| السعة الحرارية عند 25 م° | 20.786 جول/(مول.كلفن) |
| الخواص الذرية | |
| البنية البلورية | cubic face centered |
| حالة التأكسد | 0 |
| كهرسلبية | no data (مقياس باولنج) |
| طاقة التأين (المزيد) |
1st: 1520.6 kJ/mol |
| 2nd: 2665.8 kJ/mol | |
| 3rd: 3931 kJ/mol | |
| نصف قطر ذري | 71 بيكومتر |
| نصف قطر ذري (حسابيا) | 71 بيكومتر |
| نصف القطر التساهمي | 97 pm |
| نصف قطر فان دير فال | 188 pm |
| متفرقة | |
| المغناطيسية | nonmagnetic |
| ناقلية حرارية عند 300 ك° | 17.72 m واط لكل متر كلفن |
| سرعة الصوت | (gas, 27 °C) 323 m/s |
| رقم التسجيل | 7440-37-1 |
| النظائر المهمة | |
| المراجع | |
الأرغون أو الأرجون (بالإنجليزية Argon) هو عنصر كيميائي في الجدول الدوري له الرمز Ar و العدد الذري 18 ، وهو غاز أحادي الذرة، عديم اللون والرائحة، خامل كيميائياً حيث ينتمي إلى فصيلة الغازات النبيلة ، وهو أكثرها توافراً على سطح الأرض.
فهرس
|
التسمية العربية للعنصر
الرَهْوَن بالعربية (رمزه الكيميائي العربي هو) من الرَهْو أي السكون، على وزن فَعْلَن (وهو وزن العناصر الكيميائية بالعربية) ذلك أنه عنصر غير نشيط كيميائيا.
نبذة تاريخية
اشتق اسم أرغون من اليونانية (الإغريقية) αργόν التي تعني الخامل أو الكسول ، وذلك إشارة إلى خموله الكيميائي. كانت هناك شكوك من قبل العالم هنري كافيندش عام 1785 حول وجود الأرغون في الهواء، إلا أن اكتشافه تم عن طريق لورد رايلي والسير وليام رامسي عام 1894 وذلك خلال تجربة قاما خلالها بإزالة كل الأكسجين والنيتروجين من عينة من الهواء.
يعد الأرغون من أول الغازات االنبيلة التي تم اكتشافها، وكان يرمز له بالبداية بالرمز A حتى عام 1957 حيث استبدل بـ Ar.
وجوده في الطبيعة
يتواجد غاز الأرغون في الغلاف الجوي للأرض وذلك بنسبة 0.934% حجم (1.29% كتلة) ، كما يوجد في الغلاف الجوي للمريخ بنسبة 1.6% من الأرغون 40 و 5 (ج.م.م) أجزاء من المليون ppm من الأرغون 36 .
يحصل على غاز الأرغون كناتج عرضي في عملية تسيل و تجزئة الهواء تحت ضغط عالي ، أي التقطير التجزيئي للهواء.
الخواص الكيميائية
غاز الأرغون من الغازات الخاملة كيميائياً، أي أن لديه غلاف إلكتروني مكتمل، ثمانية إلكترونات في الطبقة الإلكترونية الخارجية، بالتالي غير قادر على تشكيل المركبات الكيميائية في الشروط العادية من الضغط ودرجة الحرارة. لكن في شروط قاسية تم الحصول على مركبات ثنائية وثلاثية الذرة من الأرغون ، والتي لم تتضح بنيتها بعد. بعض الاقتراحات تشير إلى أن هذه المركبات نواتج ضم برابطة فان دير فالس، في أن أخرى تقول أنها ذات طبيعة شاردية أو تكافؤية (مشتركة).
في عام 2000 تم اصطناع مركب (هيدرو فلوريد الأرغون HArF ) من قبل باحثين في جامعة هلسنكي عند تعريض الأشعة فوق البنفسجية على فلوريد الهيدروجين الموجود في (ماتريكس) من الأرغون عند درجة حرارة 7.5 كلفن.
النظائر
النظائر الرئيسية للأرغون على سطح الأرض هي 40Ar بنسبة (99.6%)، و 36Ar بنسبة (0.34%) ، و38Ar بنسبة (0.06%).
الاستخدامات
- يستخدم الأرجون في عمليات اللحام وذلك كغاز عازل لمنطقة اللحام عن الجو المحيط.
- يستخدم كغاز مالئ في مصابيح الإنارة خاصة أنه لا يتفاعل مع السلك المعدني المتوهج حتى في درجات حرارة عالية.