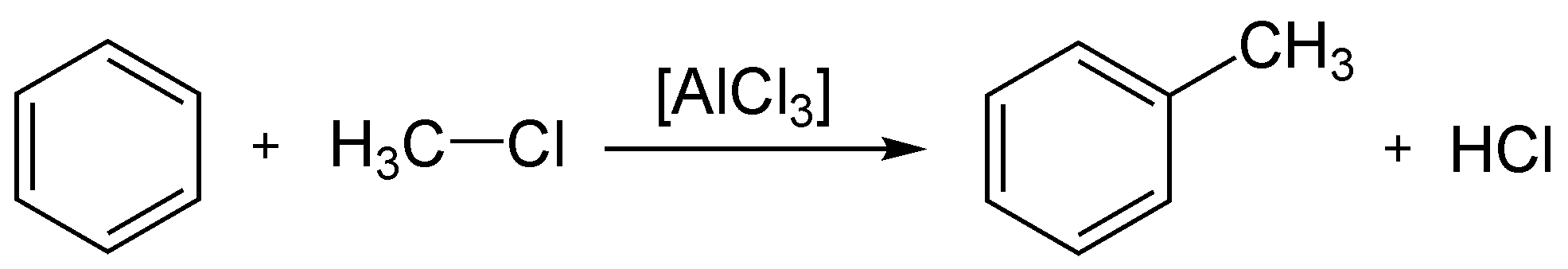| البنزين | |
|---|---|
 |
|
| الصفات العامة | |
| الإسم القياسي | بنزين |
| أسماء أخرى | بنزول |
| الصيغة الكيميائية | C6H6 |
| SMILES | C1=CC=CC=C1 |
| المعرف الدولي | InChI=1/C6H6 /c1-2-4-6-5-3-1/h1-6H |
| الكتلة المولية | 78.11 g/mol |
| المظهر | سائل عديم اللون |
| رقم CAS | [71-43-2] |
| الخواص | |
| الكثافة, والحالة | g/cm3 0.8786 ، سائل |
| الذوبانية في الماء | g/l 1.79 عند (25C°) |
| نقطة الذوبان | 5.5 K −278.6 °C |
| نقطة الغليان | 353.2 C 80.1 K ° |
| اللزوجة | 0.652 cP عند 20 C° |
| البناء | |
| الشكل الجزيئي | مسطح |
| العزم الثنائي القطبي | 0 D |
| الأخطار | |
| MSDS | شهادة بيانات أمان المواد خارجية |
| الأخطار الرئيسية | من المسرطنات, سريع الإشتعال |
| NFPA 704 | |
| نقطة الوميض | -11 C° |
| صيغة الخطر والأمان | R: 11, 23/24/25, 45, 48 S: 45, 53 |
| مركبات متعلقة | |
| هيدروكربونات متعلقة |
سيكلو هكسان نفثالين |
| مركبات متعلقة | تولوين |
| تم استخدام وحدات SI بقدر الإمكان. وإذا لم يذكر غير ذلك فقد تم إستخدام الظروف القياسية. |
|
البنزين (C6H6), فينيلH, أو البينزول هو سائل عديم اللون, قابل للإشتعال, وله رائحة لطيفة. البنزين من المواد المسرطنة. كما أنه من مركبات البنزين (وقود), والنابالم. وهو من المذيبات الصناعية المهمة, ويستخدم في صناعة الأدوية, واللدائن, والمطاط الصناعي, والصبغات. وهو أحد المكونات الطبيعية للزيت الخام, ولكنه يصنع من مكونات أخرى موجودة في النفط. والبنزين من الهيدروكربونات الأروماتية, وهو ثاني "إن"-أنولينات ([6]-أنولين).
فهرس
|
تاريخ البنزين
تم إكتشاف حلقة البنزين عام 1825 بواسطة عالم إنجليزي يسمى ميشيل فاراداي, والذى قام بعزله من الزيت الغازي وأعطاه الإسم بيكربوريت الهيدروجين. وفى عام 1833 قام الكيميائي الألماني إلهارد ميتشيرليتش بإنتاجه عن طريق تقطير حمض البنزويك (من صمغ البنزوين) والجير. وقام ميتشيرليتش بتسمية المركب بنزين. ثم قام الكيميائي الإنجليزي شارليس مانسفيلد في عام 1845 الذى كان يعمل تحت رئاسة أجوست ويليام فون هوفمان بعزل البنزين من قطران الفحم. ثم بعد أربع سنوات بدأ مانسفيلد في أول إنتاج تجاري للبنزين, بطريقة قطران الفحم.
تركيب البنزين
الصيغة الكيميائية للبنزين هى (C6H6), أوجدت نوع من التعجب عند بداية إكتشافه, حيث كانت الإقتراحات البنائية وقتها تدور حول أن ذرة الكربون غالبا ما ترتبط بأربعة ذوابط فردية مع الهيدروجين.
وكان الكيميائي فريدريك أغسطس كيكول فون سترادونتيز أول من إقترح البناء الحلقي للبنزين. وتوجد حكاية تتكرر عن أنه من كثرة دراسة الترابط في الكربون, شاهد أثناء نومه حلك يدور حول حية تأكل ذيلها, مما ألهمه الشكل الحلقي لجزيء البنزين. وعموما فقد ظهرت هذه الحكاية في (مجلة جمعية التعطش للكيمياء) والتى كانت تطبع سنويا في القرن التاسع عشر في مناسبة اجتماع الجمعية الكيميائية الألمانية.
وفى أوائل العشرينيات من القرن التاسع عشر كان لتفهم كيكول للطبيعة رباعية التكافؤ لذرة الكربون إعتمادا على أبحاث أركيبالد سكوت كوبر, بالإضافة إلى العالم النمساوي جوزيف لوشميدت الذى قام بنشر البناء الحلقي للبنزين. تم الموافقة أخيرا على الشكل الحلقى للبنزين بواسطة العالم المشهور كاثلين لونسدال.
وحتى يمكن للبنزين أن يكون به كل الروابط يجب أن يكون له روابط ثنائية معينة.
وكان لإستخدام تشتت الأشعة السينية في الأبحاث دور في إكتشاف أن الروابط كربون-كربون في البنزين لها نفس الطول, برغم أن الروابط الأحادية مفترض ان تكون أطول من الروابط الثنائية. وأيضا وجد أن طول الرابطة (المسافة بين ذرتين مرتبطتين) في البنزين أطول من طول الرابطة في الرابطة الثنائية, وأقصر من طول الرابطة في الرابطة الأحادية.
وهذا يمكن تفسيره بسبب عدم تمركز الإلكترونات. وحتى يمكن تصور ذلك, يجب الأخذ في الإعتبار مكان الإلكترونات في روابط حلقة البنزين.
أحد التمثيلات ان بناء البنزين يتواجد في الشكلين القادمين بالتبادل, وليس في أحدهما بالتحديد. ويمسى هذا التركيب الرنين المترافق.
وفى الحقيقة, لا يتواجد أى من الشكلين السابقين. فعدم التمركز لابد أن يتم تفسيره بنظريات أعلى من نظرية الروابط الأحادية والثنائية.
تتكون الروابط الأحادية من الإلكترونات الموجودة بين ذرات الكربون – ويطلق عليها سيجما σ. وتتكون الروابط الثنائية من رابطة سيجما, ورابطة أخرى تسمى رابطة باي. وهذه الرابطة الثانية لها إلكترونات تدور في مدارات أعلى وأسفل مستوى الحلقة عند كل ذرة كربون مرتبطة. وتتكون الروابط باي من مدار p الذري أسفل وأعلى مستوى الحلقة. والشكل القادم يوضح مكان هذه المدارات.
وحيث أنهم خارج مستوى الذرات, فإن هذه المدارات يمكن أن تتفاعل مع بعضها بحرية, وتصبح غير متمركزة. وعنى هذا أنه بدلا من أن تكون مرتبطة مع ذرة كربون معينة, فإن كل إلكترون تتم مشاركته بكل ذرات الكربون الستة في الحلقة, وتقوم هذه الإلكترونات بتقوية كل الروابط الموجودة في الحلقة. ويكون للمدار الجزيئي الناتج تماثل باي.
ويعرف عدم تمركز الألكترونات بالأروماتية , وهذا يعطى للبنزين ثبات عالي. وهذه هى الخاصية الأساسية للمركبات الأروماتية والتى تفرقها عن المركبات الغير أروماتية.
ولتوضبح الطبيعة الغير متمركزة للروابط في البنزين, يمكن أن يتم رسم حلقة البنزين بوضع دائرة داخل الشكل السداسي لحلقة البنزين.
ومثل الطريقة العادية لتمثيل البناء الجزيئي, فإن ذرات الكربون لا يتم توضيحها على الرسم.
ويتواجد البنزين بصورة كافية كمكون للجزيئات العضوية والتى لها رمز معين بالكود 232C ⌬.
ملحوظة: لا تستطيع عديد من المستكشفات عرض هذا الرمز.
مستبدلات البنزين
يوجد عديد من المواد الكيماوية ذات الأصل البنزيني, بإستبدال ذرة أو أكثر من ذرا ت الهيدروجين بمجموعة فعالة.
المستبدلات الألكيلية (ألكيل بنزين)
- تولوين C6H5-CH3
- زيلين C6H4(-CH3)2
- ميسيتيلين C6H3(-CH3)3
مستبدلات أخرى
- فينول C6H5-OH
- أنيلين C6H5-NH2
- كلورو بنزين C6H5-Cl
- نيترو بنزين C6H5-NO2
- حمض بكريك C6H2(-OH)(-NO2)3
- تراينيترو تولوين C6H2(-CH3)(-NO2)3
- حمض بنزويك C6H5-COOH
- حمض سالسيليك C6H4(-OH)(-COOH)
- حمض أسيتايل سالسيليك C6H4(-O-C(=O)-CH3)(-COOH)
- باراأسيتامول C6H4(-NH-C(=O)-CH3)(-OH)
- فيناسيتين C6H4(-NH-C(=O)-CH3)(-O-CH2-CH3)
الحلقات الأروماتية المتعددة
- نفثالين
- أنثراسين
- فينانثرين
- إندول
- بنزوفيوران
- كينولين
- أيزوكينولين
- هيدروكربون أروماتي متعدد الحلقات (PAH)
الحلقات الغير متجانسة المشابهة
فى الحلقات الغير متجانسة, يتم استبدال ذرات الكربون في البنزين بعناصر أخرى:
- بيريدين
- بيرازين
- بيريميدين
- بيريدازين
شاهد حلقة أروماتية بسيطة لمشابهات البنزين.
إنتاج البنزين
ينتج البنزين بصفة عامة من الإحتراق الغير كامل للمواد الغنية بالكربون. وينتج طبيعيا من البراكين حرائق الغابات, كما انه من مكونات دخان السجائر.
وحتى الحرب العالمية الثانية, معظم البنزين كا يتم الحصول عليه كمنتج ثانوي من فحم الكوك أثناء إنتاج الالصلب. وعموما, فإنه في فترة الخمسينيات من القرن العشرين زاد الطلب على البنزين, وخاصة في صناعات اللدائن الناشئة في ذلك الوقت, مما إستتبع ذلك بداية إنتاج البنزين من البترول. وحاليا يتم إنتاج معظم البنزين من الصناعات البتروكيمياوية, وكميات ضئيلة تنتج من الفحم.
وهناك ثلاث عمليات صناعية تتشارك بالتساوي في إنتاج البنزين: إعادة التكوين الحفزي, الألكلة الهيدروجينية للتولوين, تكسير البخار.
إعادة التكوين الحفزي
فى عملية إعادة التكوين الحفزي, يتم خلط مخلوط من الهيدروكربونات التى لها نقطة غليان من 60 إلى 200 C ° مع غلز الهيدروجين, ثم تعريضها كلوريد البلاتين أو كلوريد الرينيوم كعامل حفز في درجة حرارة من 500 إلى 525 C °, وضغط يتراوح من 8 إلى 50 atm. وتحت هذه الظروف, تكون الهيدروكربونات الأليفاتية حلقات بفقد هيدروجين لتصبح هيدروكربونات أروماتية. ثم يتم فصل هذه المكونات الأروماتية من التفاعل بإستخلاصها باى مذيب, مثل داي إيثيلين جليكول أو سلفولان, ثم يتم فصل البنزين بعد ذلك من المركبات الأروماتية الأخرى بالتقطير.
الألكة الهيدروجينية للتولوين
الألكلة الهيدروجينية تقوم بتحويل التولوين إلى بنزين. وفى هذه العملية يتم خلط التولوين بالهيدروجين, ثم يتم إمراره على عامل حفاز مثل الكروم, أو الموليبيدنيوم, أو أكسيد البلاتين في درجة حرارة من 500 إلى 600 C ° ىف ضغط من 40 إلى 60 atm. وأحيانا تستخدم درجات الحرارة العالية بدلا من عامل الحفز. وتحت هذه الظروف يحدث نزع ألكلة للتولوين طبقا للمعادلة الآتية:
وينتج التفاعل المثالي تقريبا 95 % بنزين من النواتج. وأحيانا يستخدم الزيلين والأروماتيات الأعلى محل التولوين, ويكون لها نفس فاعلية التولوين.
التكسير بالبخار
التكسير بالبخار هى الطريقة المستخدمة الإيثيلين والأولفينات الأخرى من الهيدروكربونات الأليفاتية. وإعتمادا على نوعية المواد الخام المستخدمة فإن عملية التكسير بالبخار يمكن أن تنتج سائل غنى بالبنزين كمنتج ثانوي يطلق عليه بنزين الإنحلال الحراري. ويمكن خلط بنزين الإنحلال الحراري يمكن أن يكون مخلوط من الهيدروكربونات, ويمكن تقطيره لمكنوناته ومنها البنزين.
إستخدامات البنزين
قبل عام 1920 كان البنزين يستخدم كمذيب صناعي لإزالة الشحوم من المواد. ونظرا لسميته العالية, فقد تم إستبداله بأنواع أخرى من المذيبات في الإستخدامات التى فيها تعرض للبنزين.
وكمادة تضاف للوقود السائل (البنزين المستخدم كوقود), فإن حلقة البنزين تزيد من رقم الأوكتان, وتسبب تقليل في طرقات المحرك. وبالتالى فإن البنزين كوقود غالبا ما يحتوى على نسب مختلفة من البنزين الحلقي, وذلك قبل فترة الخمسينيات من القرن العشرين, حيث تم استبدال البنزين الحلقي بالتيترا إيثيل رصاص والذى يتعبر من أفضل العوامل المضادة لطرقات المحرك. وعموما فإنه نظرا للإتجاه العالمي لتقليل مركبات الرصاص في الوقود, أصبح البنزين الحلقي من المركبات التى تستخدم في بعض الدول لزيادة رقم الأوكتان. وهناك قلق في الولايات المتحدة من الوقود المحتوى على البنزين الحلقي, نظرا لإمكانية تسربه للمياه الجوفيه, وبالتالى فإن هناك قيود صارمة حول استخدام البنزين كوقود بنسبة لا تزيد عن 1 % من الوقود الحلقي.
وعموما فإن البنزين يعتبر من المواد الوسيطة لإنتاج كيماويات أخرى. وأكثر المشتقات المنتجة من البنزين الستيرين, والذى يستخدم في تصنيع البوليمرات واللدائن. الفينول أيضا من مشتقات البنزين ويستخدم في تصنيع الراتينجات والمواد اللاصقة. ويستخدم الهكسان الحلقي في إنتاج النايلون. وتستخدم كميات قليلة من البنزين لإنتاج المطاط, المزيتات, الصبغات, المنظفات, الأدوية, المفرقعات, مبيد الحشرات.
تفاعلات البنزين
إستبدال أروماتي محب للإلكترونات
الإستبدال أروماتي محب للإلكترونات هو طريقة عامة للإستبدال في الحلقات الأروماتية مثل البنزين. فالبنزين محب للنواة بطريقة كافية لأن يتم استبدال عند تواجد محب للإلكترونات مثل أيونات الأسيليوم أو ألكيل كاتيونات الكربون, ويتم التفاعل ليعطي في النهاية مستبدل للبنزين.
أسيلة فريدل كرافتس
أسيلة فريدل كرافتس عى مثال محدد للإستبدال الأروماتي المحب للإلكترونات. يتضمن التفاعل أسيلة حلقة أروماتية (مثل البنزين) بواسطة أسيل كلوريد, بإستخدام عامل حفاز قوي مثل حمض لويس.
ألكلة فريدل كرافتس
ألكلة فريدل كرافتس عى مثال محدد للإستبدال الأروماتي المحب للإلكترونات. يتضمن التفاعل ألكلة حلقة أروماتية (مثل البنزين) بواسطة هالو ألكان, بإستخدام عامل حفاز قوي مثل حمض لويس.
التأثير على الصحة
يمكن أن يؤدة إستنشاق كميات كبيرة من البنزين إلى الموت, بينما التعرض للبنزين بكميات أقل يسبب النعاس, دوار, زيادة معدل ضربات القلب, الصداع, رعشة, عدم إتزان, فقد الوعي. كما أن تناول طعام به نسبة عالية من البنزين يؤدى لحدوث قيء كما يسبب تآكل جدار المعدة, الدوار, الرغبة في النوم, رعشة, زيادة معدل ضربات القلب, الموت.
كما أن التعرض الطويل للبنزين يسبب الضرر للب العظام, كما يسبب حدوث قلة في خلايا الدم الحمراء مما يؤدى لحدوث أنيميا. كما يمكن أن يؤدى ذلك لنزيف وإضعاف المناعة بالجسم.
وقد لوحظ أن السيدات اللائي تعرض للبنزين لفترات طويلة يحدث لهم إختلال في الدورة الشهرية, كما يقل حجم المبايض. ولا يعرف ختى الآن بالتحديد ما إذا كان البنزين يؤثر على تطور الحمل في النساء, أو على الخصوبة في النساء.
وأظهرت التجارب أن هناك نقص في أوزان مواليد حيوانات التجارب, تأخر في تكون العظام, تآكل لب العظام عند تعريض الأنتثى الحامل للبنزين.
وقد صنفت إدارة الصحة والخدمات الإنساسنسة الأمريكية (DHHS) البنزين على أنه من المواد المسرطنة. والتعرض الطويل للبنزين في الهواء يمكن أن يسبب اللوكيميا, سرطان الدم.
وهناك عديد من الإختبارات التى يمكن عملها لقياس معدلات البنزين في الجسم, فمثلا يمكن قياس معدل البنزين في النفس, وإن كان لابد من عمل هذا الإختبار في فترة قليلة من زمن النعرض للبنزين. كما يمكن قياس نسبة البنزين في الدم, وإن كان البنزين يختفى سريعا من الدم, فيجب إجراء اختبار الدم بسرعة للحصول على نتائج دقيقة.
ويتعرض البنزين لعملية الأيض في الجسم. ويمكن قياس بعض نواتج الأيض في البول. ولكن يجب أن يتم ذلك بعد فترة قصيرة من التعرض للبنزين, وإن كانت هذه الطريقة ليست بالدقة الكافية للتعرف على كمية البنزين التى تعرض لها الجسم, حيث أن البنزين الموجود في البول يمكن أن يكون من مصدر أخر.
وقامت وكالة حماية البيئة الأمريكية بتحديد أقصى مستوى للبنزين في مياه الشرب بكمية 0.005 ملليجرام لكل لتر (0.005 mg/L). كما طالبت أيضا بالإبلاغ عن أى كمية تسرب للبنزين تزيد عن 4ز5 كيلو جرام نتيجة الحوادث أو الخطأ.
وقامت إدارة الدفاع المدني والصحة الأمريكية (OSHA) بوضع حدود مسموحة للتعرض للبنزين وهى جزء واحد من البنزين في مليون جزء من الهواء في بيئة العمل خلال يوم عمل يبلغ 8 ساعات, وعدد ساعات إسبوعى يصل 40 ساعة.
التعرض للبنزين
العمال الذين تتطلي وظائفهم التعرض للبنزين, يمكن أن يكونوا في خطر التعرض لمادة مسرطنة. ومنها الصناعات التى تتضمن صناعة المطاط, مصافي الزيت, مصانع الكيماويات, مصانع الأحذية, الصناعات المتعلقة بالبنزين (وقود). وفى عام 1987, قدرت OSHA أن حاولي 237,000 من العمال في الولايات المتحدة يتعرضوا للبنزين, وا يمكن تأكيد ما إذا كان هذا الرقم قد تغير أم لا.
وصلات خارجية
- شهادة بيانات أمان البنزين
- دراسات بيئية طبية:سمية البنزين
- ويكي-الكيماء الحسابية
- قسم الصحة والخدمات البشرية: TR-289: دراسات السمية والسرطان للبنزين
- كيوكل وأحلام البنزين
- بناء البنزين - لوشميدت
المراجع
- أرتشيبالد سكوت كوبر, نظرية جديدة, المجلة الفلسفية, (16 ،104-116 (1858)
- جوزيف لوشميدت, تشميش شتودين أي., الدريتش كيميكال كو.,ميلووكي (1989).
- جوزيف لوشميدت, تشميش شتودين أي., الدريتش كيميكال كو.,ميلووكي (1989), لائحة رقم Z-18576-0, و(1913) لاءحة رقم Z-18577-9.
- كاثلين لونسادال, "بناء حلقة البنزين في هيكسا ميثيل بنزين", "تجارب المجتمع الملكي" 123A: 494 – 1929
- كاثلين لونسادال, "تحليل بإستخدام الأشعة السينية لبناء هيكسا كلورو بنزين, بإستخدام طريقة فورير", "تجارب المجتمع الملكي" 133A: 536 -1931