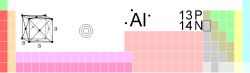
| صفات عامة | |
|---|---|
| الاسم، الرقم، الرمز | ألومنيوم ، Al ، 13 |
| سلاسل كيميائية | فلز ضعيف |
| المجموعة، الدورة، المستوى الفرعي | p ، 3 ، 13 |
| المظهر | فضي |
| كتلة ذرية | 26.9815386(13) غ/مول |
| شكل إلكتروني | [Ne] 3s2 3p1 |
| عدد الإلكترونات لكل مستوى | 2, 8, 3 |
| خواص فيزيائية | |
| الحالة | صلب |
| كثافة عند د.ح.غ. | 2.70 غ/سم³ |
| كثافة السائل عند m.p. | 2.375 ج/سم³ |
| نقطة الانصهار | 933.47 ك 660.32 م ° 1220.58 ف ° |
| نقطة الغليان | 2792 ك 2519 م ° 4566 ف ° |
| حرارة الانصهار | 10.71 كيلو جول لكل مول |
| حرارة التبخر | kJ/mol 294.0 |
| السعة الحرارية عند 25 م° | 24.200 جول/(مول.كلفن) |
| الخواص الذرية | |
| البنية البلورية | cubic face centered |
| حالة التأكسد | 3 (اكسيد متذبذب) |
| كهرسلبية | 1.61 (مقياس باولنج) |
| طاقة التأين (المزيد) |
1st: 577.5 kJ/mol |
| 2nd: 1816.7 kJ/mol | |
| 3rd: 2744.8 kJ/mol | |
| نصف قطر ذري | 125 بيكومتر |
| نصف قطر ذري (حسابيا) | 118 بيكومتر |
| نصف القطر التساهمي | 118 pm |
| متفرقة | |
| المغناطيسية | paramagnetic |
| مقاومة كهربية | 20 °C 26.50 nΩ·m |
| ناقلية حرارية عند 300 ك° | 237 واط لكل متر كلفن |
| تمدد حراري | (25 °C) 23.1 µm/(m·K) |
| سرعة الصوت (قضيب رفيع) | (ح.غ.) (rolled) 5000 م/ث |
| معامل يونج | 70 GPa |
| معامل القص | 26 GPa |
| معاير الحجم | 76 GPa |
| نسبة بواسون | 0.35 |
| صلابة موس | 2.75 |
| رقم فيكرز للصلادة | 167 MPa |
| رقم برينل للصلادة | 245 MPa |
| رقم التسجيل | 7429-90-5 |
| النظائر المهمة | |
| المراجع | |
يرجى الاطلاع على صفحة النقاش قبل القيام بالنقل
الألومنيوم عنصر في الجدول الدوري له الرمز Al والعدد الذري 13 . وهو فلز ذو لون أبيض فضي قابل للسحب، وهو من أكثر الفلزات وفرة في القشرة الأرضية، وترتيبه الثالث من بين أكثر العناصر وفرة في الكرة الأرضية بعد الأكسجين والسيليكون. يشكل الألومنيوم 8% وزناً من سطح الأرض الصلب. المصدر الرئيسي للألومنيوم هو معدن البوكسيت. يمتاز الألومنيوم بمقاومته للتآكل وبخفة وزنه حيث يدخل في صناعة الطائرات.
فهرس
|
الخواص
الألومنيوم فلز خفيف الوزن، غير ممغنط، جيد التوصيل للحرارة والكهرباء. وهو قابل للسحب ووللطرق حيث يمكن قولبته بشكل سهل نسبياً.
تعود قدرة الألومنيوم على مقاومة التآكل إلى طبقة سطحية رقيقة من أكسيد الألومنيوم التي تتشكل عندما يتعرض الفلز للهواء، مما يمنع بالتالي من استمرار عملية الأكسدة.
النظائر
للألومنيوم تسعة نظائر تتراوح كتلتها بين 23 إلى 30 . يتواجد في الطبيعة نظيرين فقط هما Al27 (نظير ثابت) وله وفرة طبيعية مقدارها 99.9%، وAl26 (مشع عمر النصف له 7.2 × 105 سنة).
تواجده في الطبيعة
فلز الألمنيوم هو أكثر العناصر الفلزية توافراً في القشرة الأرضية بعد الأكسجين والسيليكون بنسبة مقدارها 8.3%. لا يتواجد فلز الألومنيوم في الطبيعة بشكلة النقي الحر، إنما يكون في الغالب مرتبطاً مع الأكسجين على شكل أكاسيد أو سيليكات.
إنتاج الألومنيوم
كما ذكر سابقاً فإن الألومنيوم شديد الارتباط مع الأكسجين بحيث يصعب فصلهما. بالمقارنة مع الفلزات الأخرى، فإنه من الصعب أن يتم فصله من خاماته ، مثل البوكسيت، وذلك نظراً إلى الطاقة اللازمة لإرجاع أكسيد الألومنيوم Al2O3 . على سبيل المثال، فإن الإرجاع المباشر بالكربون كما يتم مع الحديد غير ممكن كيميائياً، لأن الألمنيوم بحد ذاته عامل مرجع أكثر قوة من الكربون. وبما أن لأكسيد الألمنيوم نقطة انصهار عالية نسبياً حوالي 2000 °س ، لذلك فإن الألمنيوم يستحصل عن طريق التحليل الكهربائي. يحل أكسيد الألومنيوم في هذه العملية في الكريوليت Na3AlF6 المذاب، من ثم يرجع إلى الفلز النقي. تكون درجة حرارة التشغيل لخلايا الإرجاع من 950 إلى 980 °س. يتواجد الكريوليت كمعدن في غرينلاند ، أما أكسيد الألومنيوم فيستحصل من معالجة البوكسيت بطريقة باير.
التحليل الكهربائي
إن طريقة التحليل الكهربائي لالستحصال الألومنيوم حلت محل طريقة فولر Wöhler process ، والتي كانت تتضمن إرجاع كلوريد الألومنيوم اللا مائي بالبوتاسيوم. كل من المسريين المستعملين في عملية التحليل الكهربائي مصنوعان من الكربون. عندما تصبح الخامة في الحالة المنصهرة تتحرر الشوارد (الأيونات) وتصبح حرة الحركة، وتحدث العمليات التالية على المساري:
- على المهبط (الكاثود) ، المسرى السالب؛ نحصل على الألومنيوم
يلاحظ هنا أن الألومنيوم حدثت عليه عملية إرجاع (ربح إلكترونات) ، ويتشكل الألمنيوم الحر بشكله الفلزي، ويهبط إلى القاع.
- على المصعد (الأنود) ، المسرى الموجب؛ يتحرر الأكسجين
باستمرار تعرض مسرى الكربون للأكسجين تحدث عملية أكسدة له، حيث يتشكل ثنائي أكسيد الكربون
لذلك يجب استبدال قضبان الكربون على المسرى الموجب باستمرار كونها تستهلك أثناء سير العملي
الاستخدامات
يستخدم على نطاق واسع في منتجات عديدة في حياتنا اليومية في أدوات المطبخ، الأثاث، لعب الأطفال، مزيلات العرق، أدوية عسر الهضم، أجزاء في الطائرات والصواريخ، رقائق الألومنيوم الشهيرة بالفويل التي تستخدم في المطبخ للف الأطعمة