الكبريت ( Sulphur )
 |
الكبريت عنصر لا فلزي أصفر اللون يُستخدم أساسًا في صناعة حمض الكبريتيك ذي الأهمية الصناعية. |
ويوجد الكبريت بمفرده في الطبيعة، وفي الفحم الحجري، والزيت الخام والغاز الطبيعي وصخر الزيت، وفي كثير من المواد المعدنية.
وأكثر المواد المعدنية الكبريتية وجودًا هو مركب الكبريت والحديد الذي يسمى البيريت. ويحتوي الغلاف الجوي للزهرة (فينوس) على الكبريت. ويعتقد بعض العلماء أن جوف المريخ يتألف من كبريتيد الحديد النقي، وهو مركب آخر من الحديد والكبريت. وقد وجد الفلكيون مركبات الكبريت في السحب الواقعة بين النجوم وفي النيازك.
وتحتاج كل النباتات والحيوانات إلى كميات ضئيلة من الكبريت لتبقى على قيد الحياة، وتتحصل النباتات عليه من التربة.وكثيرمن الأطعمة النباتية ومن بينها الكرنب (الملفوف)، والبصل، وطحين الصويا، أطعمة غنية بالكبريت. كما يحتوي المثيونين ـ وهو حمض أميني يحتاجه الإنسان في غذائه ـ على الكبريت أيضًا. ويوجد الكبريت في بعض الأطعمة مثل البيض ومنتجات الألبان واللحوم.
الاستخدامات:
كل الكبريت المُستخرج حاليًّا يستخدم في تحضير حمض الكبريتيك، وهو مركب كبريتي، ويُعد أهم مادة كيميائية تجارية في العالم. ويستخدم في إنتاج الأصباغ والدهانات (الطلاء)، والورق والمنسوجات وعدد من الكيميائيات الصناعية. كما يُستخدم أيضًا في إنتاج الفلزات وفي تكرير النفط.أما المنتجات الأخرى المحتوية على الكبريت، فتشمل بعض أنواع الأسمدة، والمتفجرات ومبيدات الفطر والحشرات، والمطاط، والشامبو، والبطاريات (المراكم) وكذلك المواد الكيميائية المستخدمة في أفلام التصوير. كما يدخل الكبريت في صناعة الأدوية كواحد من المكونات. ويمكن استخدامه في إنشاء الطرق بدلاً من الأسفلت.
الخواص:
الكبريت لاطعم له ولارائحة، ووزنه الذري 32,064، وعدده الذري 16. وينصهر عند درجة 120°م إذا سخن تدريجيًا، أمّا إذا سخن بسرعة فينصهر عند درجة 113°م. ويغلي عند درجة 444,6°م، وعند درجات حرارية أعلى من 150°م يصير غليظًا ولزجًا. ويصير أكثر سيولة مرة أخرى بعد أن تصل درجة الحرارة إلى أعلى من 250°م ويتغير لونه من الأصفر إلى الأحمر. أما لونه عند الغليان فهو بني قاتم.والكبريت عنصر متفاعل جدًا، ويشتعل في الهواء عند درجة 250°م. وباحتراقه يتحد مع الأكسجين ليكون ثاني أكسيد الكبريت، وهو غاز عديم اللّون يوجد بكثرة في الأماكن المكتظّة بالسكان. وقد اقترن هذا الغاز بأمراض التنفُّس وإتلاف المباني والأمطار الحمضيّة ★ تَصَفح: المطر الحمضي.
وأغلب كميّات هذا الغاز الموجودة في الهواء تنتج من احتراق الفحم الحجري المحتوي على الكبريت. وتحُدّ قوانين حماية البيئة في دول كثيرة من كميات الكبريت التي تفرز بوساطة منشآت الطاقة الحارقة للفحم الحجري.
الأشكال:
يوجد الكبريت في أشكال عدّة تُسمى المتآصلات، وأكثر المتآصلات شيوعًا هو الكبريت معيِّني الشكل، وهو مادة متبلِّرة صفراء ليمونيّة اللّون وثابتة عند درجة حرارة الغرفة. أما الكبريت أحادي الميل أو الموشوري، فهو ثابت فقط ما بين درجة 94°م و120°م. وتوجد كبلورات إبريّة طويلة عديمة اللّون تقريبًا.أما الكبريت غير المتبلر أو البلاستيكي فهو ناعم وليّن ولزج و يتمدد كالمطاط. وكلا النوعين ـ الكبريت أحادي الميل والكبريت غير المتبلر ـ يتحولان إلى الكبريت معيني الشكل عند درجة حرارة الغرفة.
ويمكن تحضير الكبريت معيني الشكل بعدة طُرُق للاستخدام التجاري. فمثلاً تتكون حبيبات الكبريت الناعمة عند تكثيف الكبريت. وتسمى هذه الحبيبات زهور الكبريت لأنها توجد في نسق كالأزهار. ويصنع الكبريت الأسطواني بتقوية الكبريت السائل في قوالب أسطوانية الشكل، أما كتل الكبريت فتحضر برش الكبريت المنصهر في أحواض الماء.
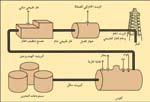 |
طريقة الحصول على الكبريت |
كيفيّة الحصول على الكبريت:
تحصلت كثير من الصناعات قبل القرن العشرين على الكبريت من الترسبات البركانية ومن مناجم الكبريت في صقلية ومن البيريت المحمّص. وظلّت الولايات المتحدة المنتج الرائد للكبريت منذ عام 1900م. وحتى الخمسينيات من القرن العشرين اعتمد إنتاج الكبريت على طريقة فراش. فقد اكتشف هيرمان فراش، المهندس الكيميائي الأمريكي، عام 1891م، أن بالإمكان صهر الكبريت وهو في باطن الأرض وذلك بوساطة بخار مسخن لأكثر من درجة حرارة غليان الماء. وفي هذه الطريقة يُسخّن الماء تحت الضغط إلى درجة حرارية أعلى من درجة انصهار الكبريت. ويُضخ الماء بوساطة المضخات إلى داخل الأرض حيث يصهر الكبريت إلى سائل مزبد خفيف. ويرفع الكبريت السائل إلى السطح بوساطة الهواء المضغوط. وأغلب الكبريت المنتج بهذه الطريقة له درجة نقاء تتراوح ما بين 99,5% و99,9%.ومازالت طريقة فراش تستخدم بتوسُّع، إلا أن أغلب كميات الكبريت المنتجة حاليًا تأتي من مركبات الكبريت الموجودة بالزيت والغاز الطبيعي. وتحول هذه المركبات إلى كبريتيد الهيدروجين في موقع المصفاة أو البئر. يسخن الكبريتيد ويحول من بعد ذلك إلى الكبريت بدرجة نقاء 99,99%.
هذه العملية التي تُسمى تحويل كلوس اقترحها المهندس الكيميائي البريطاني س.ف.كلوس عام 1883م.
★ تَصَفح أيضًا: الكبريتات ؛ الكبريتيد ؛ السلفا ؛ ثاني أكسيد الكبريت ؛ حمض الكبريتيك.