النشاط الإشعاعي ( Radioactivity )
☰ جدول المحتويات
النشاط الإشعاعي مصطلح يعبر عن العملية التي تطلق فيها الذرة الإشعاع أو الجسيمات الذرية أو الأشعة ذات الطاقة العالية من نواتها. يربو عدد الأنواع المختلفة من الذرات المعروفة على 2,300 نوع، والمشع منها يزيد على الألفي نوع، منها نحو50 نوعًا توجد في الطبيعة. أما البقية فقد استحدثها العلماء صناعيًا. ولقد اكتشف النشاط الإشعاعي، الفرنسي أنطوان هنري بكويريل في عام 1896م.
أنواع الإشعاع
توجد ثلاثة أنواع من الإشعاع النشط: جسيمات ألفا، وكان بكويريل أول من تعرف عليها ؛ وجسيمات بيتا التي تعرف عليها النيوزيلندي إرنست رذرفورد ؛ وأشعة جاما التي تعرف عليها الزوجان الفرنسيان ماري وبيير كوري.
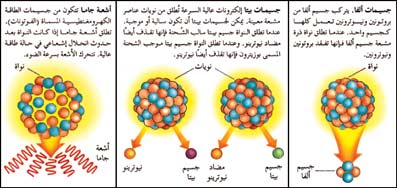 |
الجسيمات المنطلقة من الذرات المشعة |
جسيمات ألفا:
تحمل شحنات كهربائية موجبة. ويتركب جسيم ألفا من بروتونين ونيوترونين، أي أنه يماثل نواة ذرة الهيليوم. تنطلق جسيمات ألفا بطاقات عالية، ولكنها سرعان ما تفقدها عند مرورها في المادة. وبمقدور ورقتين من أوراق هذه الموسوعة إيقافها. ★ تَصَفح: جسيم ألفا.جسيمات بيتا:
وهي إلكترونات. تطلق بعض النوي المشعة إلكترونات عادية تحمل شحنات كهربائية سالبة. لكن البعض الآخر يطلق بوزيترونات وهي إلكترونات ذات شحنة موجبة. وتنتقل جسيمات بيتا بسرعة تقارب سرعة الضوء ويستطيع بعضها أن ينفذ خلال 13ملم من الخشب. ★ تَصَفح: جسيم بيتا.أشعة جاما:
أشعة غير مشحونة كهربائيًا. وتشبه هذه الأشعة الأشعة السينية، إلا أنها تكون في الغالب ذات طولٍ موجي أصغر. ★ تَصَفح: الأشعة السينية. وهذه الأشعة هي فوتونات (جسيمات الإشعاع الكهرومغنطيسي)، وتنتقل بسرعة الضوء. تخترق أشعة جاما الأجسام بدرجةٍ أكبر من جسيمات ألفا أو بيتا. ★ تَصَفح: أشعة جاما.خواصُّ النَّوَى
لكي نفهم ما يحدث داخل ذرة مشعة، يجب علينا أن نتعرف على تركيب النواة. يسمى عدد البروتونات في نواة الذرة العدد الذري. ولكل عنصر عدد ذري مختلف. فالهيدروجين مثلاً له بروتون واحد، ولذا فإن عدده الذري 1، واليورانيوم عدده الذري 92 لأن نواته تحتوي على 92 بروتونًا. ويسمى العدد الكلي من البروتونات والنيوترونات في نواة الذرة، العدد الكُتلي. وتحتوي نواة الهيدروجين العادي على بروتون واحد، وليس بها نيوترونات، ولذا فإن العدد الكتلي للهيدروجين العادي هو واحد. أما نواة الهيدروجين الثقيل، أي (الديوتريوم) فإنه يوجد بها بروتون واحد ونيوترون واحد، ولذا فإن عدده الكتلي 2. كما أن أحد الأنواع المشعة للهيدروجين والمسمى تريتيوم له العدد الكتلي 3، وذلك لأن به بروتونًا واحدًا ونيوترونين. ولكن الأنواع الثلاثة للهيدروجين لها نفس العدد الذري. وتسمى الذرات التي لها نفس العدد الذري ولها أعداد كتلية مختلفة النظائر. أي أن الهيدروجين العادي والديوتريوم والتريتيوم، كلها، نظائر لعنصر الهيدروجين، ويكتبها العلماء عادة 31H , 21H , 11H. ويمثل العدد الأسفل العدد الذري، في حين أن العدد الأعلى يمثل العدد الكتلي. وجميع نظائر أيِّ عنصر ذات خصائص كيميائية واحدة. ★ تَصَفح: الذرة ؛ النظير.
ابتعاث الإشعاع
تنشأ الأنواع المختلفة من الإشعاع في نوى الذرات المشعَّة. وما جسيم ألفا، المكوَّن من بروتونات ونيوترونات، إلا شَظيَّة من النواة التي أطلقته. أما إلكترون أشعة بيتا، فإنه ينشأ في النواة عندما يحدث تغيُّر لأحد الجسيمات فيها. وعندما تطلق الذرات إشعاع ألفا أو بيتا، فإنها تتغير إلى ذرات عناصر أخرى، يُسمِّي العلماء ذلك التغير التحوُّل أو التبدُّل. أما ابتعاث أشعة جاما فينتج عنه تحرر للطاقة فقط ولا يحدث بسببه تحوُّل. ★ تَصَفح: تحول العناصر.
إشعاع ألفا:
إذا أُطلقت نواة جسيم ألفا، فإنها تفقد بروتونين ونيوترونين. وكمثال على ذلك، فإنَّ إشعاع ألفا ينطلق من اليورانيوم 238 وهو نظير لليورانيوم له 92 بروتونًا و146 نيوترونًا. وبعد فقدان جسيم ألفا، يصبح للنواة 90 بروتونًا و 144 نيوترونًا. لكنَّ الذرة التي لها العدد الذريّ 90 ليست ذرة يورانيوم بل ذرة ثوريوم. والنتيجة، إذن، هي تَكوُّن النظير ثوريوم 234.إشعاع بيتا:
عندما تُطلق نواة جسيم بيتا، فإنها تُطلق أيضًا نيوترينو مضاد وهو جسيم غير مشحون كتلته تكاد تكون منعدمة. وعندما ينطلق جسيم بيتا السالب يتحول النيوترون في النواة إلى بروتون وإلكترون سالب ونيوترينو مضاد. ينطلق الإلكترون والنيوترينو المضاد لحظة تكونهما، بينما يبقى البروتون في النواة. وهذا يعني أن بها بروتونًا زائدًا كما أن بها نيوترونًا ناقصًا. فمثلاً يطلق نظير للكربون 146C ، إلكترونات سالبة. وفي ذرة الكربون 14 أو(14C)، يوجد 6 بروتونات و8 نيوترونات. وعندما تتحول هذه النواة، يتغير نيوترون إلى بروتون وإلكترون ونيوترينو مضاد. وبعد ابتعاث الإلكترون والنيوترينو المضاد، تصبح النواة محتوية على سبعة بروتونات وسبعة نيوترونات. وهنا، فإن العدد الكتلِي ظل ثابتًا مع أن العدد الذري ازداد واحدًا. والنيتروجين هو العنصر الذي له العدد الذري 7. أي أن 146C تحول إلى 147N بعد انطلاق جسيم بيتا سالب.وعندما تُطلق نواة بوزيترونًا، يتحوَّل البروتون في النواة إلى نيوترون وبوزيترون ونيوترينو. ينطلق كل من البوزيترون والنيوترينو لحظة تكوُّنهما، على حين أن النيوترون يظل في النواة. ويطلق أحد نظائر الكربون 116C بوزيترونات. ولهذا النظير 6 بروتونات و 5 نيوترونات، وعندما يطلق بوزيترونًا يتحوَّل أحد بروتونات النواة إلى نيوترون وبوزيترون ونيوترينو. وبعد انطلاق البوزيترون والنيوترينو، تظل النواة محتوية على 5 بروتونات و 6 نيوترونات. وهنا، فإن العدد الكتلي ظل ثابتًا على حين أن العدد الذري نقص بمقدار واحد. والبورون هو العنصر الذي رقمه الذري 5. أي أن 116C تغير إلى 115B بعد إطلاق بوزيترون ونيوترينو.
أشعة جاما:
تنشأ أشعة جاما بطرق متعددة. فقد لا يحمل جسيم ألفا أو جسيم بيتا، المنطلق من النواة، كل الطاقة المتاحة. عندئذ، تكتسب النواة طاقة أكبر من تلك التي تجعلها مستقرة. وتتخلص النواة من الطاقة الزائدة بإطلاق أشعة جاما. لكن ابتعاث إشعاع جاما لا يصاحبه حدوث تحول.نصف العمر
عدد الجسيمات المنطلقة من عينة نظير مشعّ في فترة زمنية هو نسبة مئوية محددة من عدد ذرات العينة. فمثلاً، ينحل من أي عينة من 11CC
3,5% منها كل دقيقة. فإذا بدأنا بعينة ما من 11C، فإنه لن يتبقى منها بعد أول دقيقة إلا 96,5%. وفي نهاية الدقيقة الثانية يتبقى 96,5% من العينة عند بدء هذه الدقيقة، أي 96,5% من 96,5% من العينة الأصلية، أي 93,1% من العينة الأصلية. وبعد عشرين دقيقة لن يبقى من الكمية الأصلية إلا نصفها فقط. وهذا معنى قولنا أن نصف عمر 11C
20 دقيقة. ويُسَمَّى هذا الفناء التدريجي للمادة الانحلال الإشعاعي أو التحوُّل النووي. وللنظائر المختلفة أنصاف أعمار مختلفة. ويتراوح نصف العمر من كسور من الثانية إلى بلايين السنين. وفيما عدا استثناءات قليلة، فإن النظائر المشعة الموجودة في الطبيعة بكميات يُمكن ملاحظتها هي فقط تلك التي لها نصف عمر يبلغ ملايين كثيرة من السنين، أو حتى بلايين السنين. ويعتقد العلماء أنه عندما تكوَّنت عناصر الأرض، كانت كلُّ النظائر الممكنة موجودة. وفي الغالب، تحللت تلك التي لها أنصاف أعمار قصيرة بحيث لم يبق منها إلا كميات أصغر من أن تلاحظ. ولكن بعض النظائر ذات العمر القصير، الموجودة في الطبيعة، تكوَّنت نتيجة انحلال نظائر مشعة طويلة العمر. فمثلاً، ينتج الثوريوم 234، الذي له نصف عمر قصير، من اليورانيوم الذي له نصف عمر طويل. كذلك تُنتج الأشعة الكونية، الكربون 14، وهو نظير نصف عمره قصير نسبيًّا. ★ تَصَفح: الأشعة الكونية. ومن النظائر المشعة ذات العمر الطويل الموجودة على الأرض، البوتاسيوم 40، والثوريوم 232، واليورانيوم 235، واليورانيوم 238.
ويُنتج المفاعل النووي صناعيا مئات النظائر المشعة قصيرة العمر، وذلك بإطلاق نيوترونات أو جسيمات نووية سريعة على النوى. ★ تَصَفح: المفاعل النووي. فإذا أُطلق نيوترون أو جسيم آخر على نواة ذرة، يصبح من المحتمل أن تقوم النواة بأسر ما ارتطم بها. وفي بعض الأحيان تقوم النواة بأسر جسيم فيها ثم يلي ذلك مباشرة أن تقوم النواة بطرد أحد جسيماتها.
استخدامات النظائر المشعَّة
في الصناعة:
تُستخدم النظائر المشعة لأغراض كثيرة. فتُستخدم أشعة جاما في فحص السبائك الفلزية والكشف عن نقاط الضعف في لحامات خطوط أنابيب النفط. تمر الأشعة في الفلز، فإذا كان به مناطق ضعيفة ظهرت بقع داكنة على الفيلم الفوتوغرافي. كما تُستخدم أشعة بيتا للتحكم في سُمْك ألواح المواد. يوضع نظير مشع تنطلق منه جسيمات بيتا فوق اللوح، ويوضع على الجانب الآخر كشَّاف لجسيمات بيتا وظيفته قياس شدة الإشعاع المارّ. فإذا زاد سمك اللوح، وصل إلى الكشاف عدد أقل من الجسيمات. ويتحكم الكشاف في آلات الدحرجة، بحيث يُحافظ على السُمْك المطلوب للوح.في الأبحاث:
يستخدم العلماء النظائر المشعة كعناصر استشفافية لتبيّن كيفية تصرف المواد الكيميائية في أجسام النبات والحيوان. وكلُّ نظائر العنصر متكافئة كيميائيا، ولذا فإنه يمكن استخدام النظير المشع بنفس الطريقة التي نستخدم بها النظير العادي. فمثلاً، لكي يقتفي عالم النبات مسار الفوسفور في النبات فإنه يقوم بخلط الفوسفور المشع بالفوسفور العادي. ولمعرفة متى وصل الفوسفور إلى ورقة النبات، فإنه يمكن وضع كاشف الإشعاع -عداد جايجر- قرب الورقة. ولمعرفة مكان الفوسفور في الورقة فإنه يمكن وضعها على لوح ضوئي. وعلى اللوح المُظهَّر الذي يسمى المرسمة الإشعاعية الذاتية تحدد موضع النظير المشع على الورقة.ويُستخدم نظير الكربون المشع 14C على نطاق واسع في تحديد أعمار المواد الأقدم من التاريخ المدوّن، كما أن الجيولوجيين يستخدمون نظائر مشعة أخرى لمعرفة أعمار الصخور. ★ تَصَفح: الكربون المشع ؛ الجيولوجيا الإشعاعية.
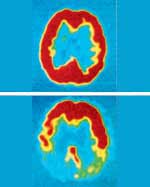 |
النظائر المشعة تستخدم في الطب النووي. فعندما يحقن النظير المشع في أحد الأعضاء يصبح بإمكان جهاز خاص أن يترجم الإشعاعات الصادرة من العضو إلى صور. وتوضح الصورتان دماغًا عاديا (فوق) ودماغ شخص مصاب بمرض ألزهايمر (تحت). والتغيرات في اللون في الصورة السفلى توضح تدمير خلايا الدماغ الذي يدل على ذلك المرض. |
في الطب:
يُشكِّل استخدام النظائر المشعة في الطب جزءًا من التخصص المسمَّى الطب النووي. ويتمثل الاستخدام الرئيسي لها في دراسة وظائف أعضاء مختلفة من الجسم. يتحقق ذلك بإضافة النظير المشع إلى المادة الحاملة التي تتراكم في العضو الذي يود الطبيب دراسته. فمثلاً، عندما يريد الطبيب أن يدرس وظائف كُلية مريض، فإنه يضيف نظيرًا مشعًا إلى مادة حاملة تتجمَّع في الكُلية. وتُطلق المادة المشعة أثناء تحللها أشعة جاما يُلتقط بعضها بجهاز يسمَّى الماسحة. يرى الطبيب الصورة على الماسحة ويتبين منها إن كانت الكلية تؤدي مهمتها على الوجه السليم.كما أنَّ النظائر المشعة تستخدم في علاج السرطان. لكن الجرعات الكبيرة منها تؤدي إلى تدمير الخلايا الحية السليمة وبخاصة تلك التي تمر بعملية انقسام. ولأنَّ الخلايا السرطانية تنقسم بمعدل أعلى من معدل الخلايا العادية، فإن الإشعاع يدمر من الخلايا السرطانية أكثر مما يدمِّر من الخلايا السليمة.والواقع أن الطبيب يستغل هذه الحقيقة، فيعطي نظيرًا مشعًا يتراكم في العضو المصاب. فمثلاً، يمكن استخدام نظير مشع لليود في معالجة سرطان الغُدة الدرقية لأن هذه الغدة تختزن اليود. وفي أثناء تحلُّل اليود المشعّ، يُصدر اليود إشعاعًا يقتل الخلايا السرطانية.
أخطار الإشعاع
يدمِّر الإشعاع الخلايا الحية. ولذا تجب حماية الأفراد الذين يتعاملون مع المواد المشعة من الإشعاع. ★ تَصَفح: الإشعاع ؛ داء الإشعاع. وتُمتص جسيمات ألفا وبيتا بشيء من السهولة، أما أشعة جاما فلها قدرة عالية على الاختراق. وتمتص العناصر ذات العدد الذريّ الكبير أشعة جاما بدرجة أفضل من تلك التي لها عدد ذري صغير. ★ تَصَفح: العنصر الكيميائي.