النظير ( Isotope )
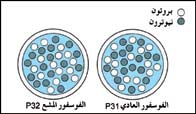 |
نظائر العنصر تحتوي على عدد مختلف من النيوترونات. فمثلاً يوجد في الفوسفور العادي P-31، 16نيوترونًا (إلى اليمين)، بينما يحتوي الفوسفور المشع P-32 على 17 نيوترونًا (إلى اليسار). |
ومعظم العناصر لها بضعة نظائر موجودة في الطبيعة. فالهيدروجين على سبيل المثال، له ثلاثة نظائر. ويسمى أخف نظيرٍ من نظائر الهيدروجين البروتيوم، وهو النظير الأكثر توافرًا، وعدده الكتلي 1، أي أن نواة الذرة تتضمن جسيمًا واحدًا لاغير. هذا الجسيم هو بروتون وله شحنةٌ موجبة. أما النظير الثاني فيسمى الديوتريوم وعدده الكتلي 2. وتتضمن نواة ذرة الديوتريوم جسيمين ـ بروتون ونيوترون. والأخير متعادل كهربيًا وله كتلةٌ تساوي في معظم الحالات كتلة البروتون. أما أثقل نظائر الهيدروجين، وهو التريتيوم، فعدده الكتلي يساوي 3، وهو مشع. وتتضمن نواة هذه الذرة ثلاثة جسيمات: بروتونا ونيوترونين. ★ تَصَفح: الذرة.
يحدد عدد البروتونات في نوى ذرات عنصر من العناصر العدد الذري للعنصر. فالعدد الذري للهيدروجين يساوي واحدًا. ولانجد لعنصرين من العناصر العدد الذري ذاته. فكل عنصرين متتاليين، تتضمن نواة العنصر الأثقل منهما بروتونًا واحدًا أكثر. فاليورانيوم، وهو أثقل عنصر موجود في الطبيعة بكميات تذكر، له 92 بروتونًا، ولذا فإن عدده الذّري 92. وكل نظائر عنصر من العناصر تتضمن العدد نفسه من البروتونات، إلاّ أنها تتباين في عدد النيوترونات. وهكذا فإن العدد الكتلي لنظير يساوي عدد البروتونات زائدًا عدد النيوترونات.
يستخدم العلماء رموزًا في تعيين النظائر، فبالنسبة لليورانيوم (الرمز الكيميائي: U)، يتعين النظير ذو العدد الكتلي 235 بكتابته 235U. ولما كانت كافة ذرات أي عنصر لها العدد الذري نفسه، لذا يمكن حذفه فيكتب: 235U، كما يمكن كتابته: U -235.
تمتاز بعض العناصر بأن لها نظائر كثيرة في الطبيعة. فالقصدير مثلاً، له عشرة نظائر. وأخف نظائر القصدير هو 112 Sn، والنظير الأثقل هو 124 Sn. أما النظير الأكثر وفرة من نظائر القصدير، فهو 120 Sn، إذ يشكل نحو ثلث العنصر. ويعد النظير 115 Sn أقلها وفرة، فهو يشكل 0,34% فقط، من ذرات القصدير. وتتساوى نسب النظائر المختلفة ـ باستثناء حالات قليلة معينة ـ في عينة أي عنصر من العناصر، بغض النظر عن مصدر العينة، وذلك لأن النظائر المختلفة لأي عنصرٍ لها ـ في الغالب ـ الخصائص الكيميائية ذاتها.
النظائر المشعّة:
يوجد في الطبيعة أكثر من 270 نظيرًا ثابتًا، ونحو 50 نظيرًا آخر مشعا، بما فيها نظائر اليورانيوم والراديوم. وتسمى هذه النظائر التي تقذف جسيمات أو أشعة نظائر مشعة.وكل العناصر التي هي أثقل من البزموت (عدده الذري 83) مشعة. وتنحل (تتفكك) هذه الذرات المشعة وتتحول إلى نظائر لعناصر أخرى أخف وزنًا. فهي تنتمي إلي ثلاث سلاسل انحلال مشعة تبدأ بـ 238 U و235 U و232 Th. وتنحل هذه الذرات الثقيلة إلى نظائر مختلفة، وتستمر هكذا حتى تتحول إلى نظائر الرصاص المستقرة الثابتة. أما السرعة التي تنحل بها النظائر المشعة فتقاس بنصف العمر، أو بالوقت اللازم حتى تنحل ذرات عينة ما إلى النصف. ولكلِّ نظير نصف عمر معين. وبعض النظائر في السلاسل المشعة تنحل ببطء. فنظير الراديوم 226Ra مثلا، له نصف عمر يصل إلى 1,600 سنة. وبعض العناصر الأخرى تنحل بسرعة فائقة، حتى أن أنصاف أعمار بعضها يساوي جزءًا صغيرًا من ثانية. ويمكن للنظائر ذات أنصاف الأعمار القصيرة أن توجد في الطبيعة. فهي تتكون باستمرار عن طريق الانحلال الذي يحصل للنظير الأم الأثقل في السلاسل.
ويوجد قليل من النظائر المشعة المتناثرة التي لا تنتمي إلى السلاسل، بين العناصر الأخف من البزموت. من هذه العناصر عنصر البوتاسيوم -40، والروبيديوم -87، والسمريوم -146، واللوتيتيوم -176، والرينيوم -187.
فصل النظائر:
طّور العلماء في مطلع الأربعينيات من القرن العشرين، خلال الحرب العالمية الثانية، طرقًا لفصل كمياتٍ ضخمة من نظائر متنوعة. وقد أجدى، بوجه خاص، فصل نظائر اليورانيوم ونظائر الهيدروجين. فاليورانيوم 235 U، على سبيل المثال، فصل من اليورانيوم 238 U المتوافر بكميات أكثر، وذلك للاستخدام في القنابل الذرية وفي مفاعلات نووية مختلفة. وبالمقابل كان لابد من فصل الديوتريوم 2H، من النظير الهيدروجين الخفيف 1H الوفير، وذلك للاستخدام في بحوث الاندماج الهيدروجيني وفي أغراض أخرى. ★ تَصَفح: الاندماج.وتستند طرق فصل الديوتريوم من الهيدروجين الخفيف إلى حقيقة مفادها أن الديوتريوم أثقل من الهيدروجين الخفيف مرتين. وتتوقف سرعة تفاعل كيميائي على كتلة العنصر. والفرق النسبي بين كتلتي نظيري الهيدروجين كبير. وعليه فإن تفاعلاً يدخل فيه الديوتريوم يتم بسرعة مختلفة عن سرعة تفاعل يدخل فيه الهيدروجين الخفيف. وقد استفاد العلماء من هذا المبدأ ففصلوا الديوتريوم من الهيدروجين بمقدار كبير. وهم ينتجون كميات كبيرة من الديوتريوم في كل عام. والفرق النسبي في الكتلة بين البورون 10 والبورون 11 أيضًا كبير، ويكفي لاستخدام طريقة الفصل هذه.
أما الفرق النسبي في الكتلة بين نظائر اليورانيوم المختلفة فصغير، مما اضطر العلماء إلى استخدام طرق أخرى في فصلها. وأكثر هذه الطرق نجاحًا هي الطريقة المسماة بالانتشار الغازي. وتستند هذه الطريقة إلى حقيقة مفادها أن جزيئًا ثقيلاً في غاز ما، يتحرك أبطأ نوعاً ما من جزىء أخف. ونتيجة لذلك فإن جزيئا يتضمن النظير الأخف، في مركب غازي يحتوي على اليورانيوم، سوف تنفذ عبر الثقوب الدقيقة في صفيحة مسامية بيسر وسهولة أكثر من النظير الأثقل. وإذا أعيدت هذه العملية بضع مئات من المرات على نسق واحد، انفصلت النظائر بعضها عن بعض. وهكذا تفصل المختبرات الضخمة كميّات كبيرة من نظائر اليورانيوم وفقًا لهذه الطريقة.
ومن الممكن الحصول على نظائر نقية لمعظم العناصر، بكمياتٍ صغيرة للأغراض البحثية التجريبية. يحصل على هذه النظائر بطريقة أخرى، يمكن أن تحّور لتكون ملائمة الاستعمال بالنسبة لعناصر كثيرة. يؤين التفريغ الكهربائي بخار العنصر أو بخار مركب يتضمن العنصر، وينسلخ خلال التأيين أحد الإلكترونات التي تدور حول نواة الذرة. وبذا يترك الذرة التي تكتسب شحنة موجبة.
يسرِّع حقل كهربائي الذرات المشحونة التي يقال لها أيونات، إلى طاقة معينة. وتولّد هذه العملية حزمة من الأيونات لها الطاقة نفسها. أما إذا عطف حقل مغنطيسي الحزمة الأيونية، فإن الأيونات المتباينة في الكتل تنفصل بعضها عن بعض في دوائر تختلف في أنصاف أقطارها، حيث تتألف كلٌّ دائرة من نظير مختلف عن نظائر العنصر الأخرى. أما العملية فتتم في وعاء أُفرغ من الهواء. وقد استخدم علماء الولايات المتحدة هذه الطريقة خلال الحرب العالمية الثانية وذلك لفصل نظائر اليورانيوم. وعمومًا، فإن طريقة الانتشار الغازي أقل تكلفة. وهناك طريقة مشابهة إلى حد ما تسمى التنظير الطيفي الكتلي، تستعمل في قياس الوفرة النسبية للنظائر الموجودة في الطبيعة، وتستخدم كذلك في تحديد كتل النوى تحديدًا محكمًا. وقد استخدم عدد من طرق أخرى في فصل النظائر.
النظائر المشعة صناعيًا:
تمكّن العلماء من إنتاج كثير من النظائر المشعة صناعيًا. وهي ليست موجودة في الطبيعة، ولو وجدت لانحلت منذ زمن بعيد. يمكن إنتاج هذه النظائر صناعيًا، إما في السيكلوترونات، وغيرها من الأجهزة المسرِّعة للجسيمات، أو في المفاعلات النووية. ويمكن للعلماء ـ مثلاً ـ أن يقذفوا نظيرًا من نظائر الصوديوم 23 Na بديوترونات ذات طاقة عالية في السيكلوترون. والديوترون جسيم مكون من بروتون ونيوترون، وإذا اصطدم بذرة صوديوم 23Na، حدث تفاعل نووي، يغدو فيه النيوترون جزءًا من نواة الذرة، وينطرح بروتون منتجا 24Na. ★ تَصَفح: معجل الجسيمات. كذلك تصنع النظائر المشعة بتعريض العناصر في مفاعل نووي إلى عدد ضخم من النيوترونات. فذرات الصوديوم 23Na، على سبيل المثال تقتنص نيوترونات من المفاعل وتتحول إلى 24Na. ويؤدي انشطار (أو انفلاق) اليورانيوم إلى نشوء أكثر من 450 نظيرًا مشعًا، وأكثر من 100 نظير ثابت مستقر.وقد تمكن العلماء من إنتاج نحو 1,700 نظير مشع، شملت كافة العناصر. واليوم يوجد للعديد من العناصر 15 نظيرًا صناعيًا أو أكثر.
كذلك أمكن إنتاج كل العناصر التي لاتوجد في الأرض. ومن هذه العناصر التكنيتيوم والبروميثيوم اللذان يوجدان في بعض النجوم ـ والعناصر 93 إلى 112، وهي ماتعرف بعناصر ما فوق اليورانيوم. ★ تَصَفح: عنصر مافوق اليورانيوم.
ولهذه العناصر المشعة أنصاف أعمار قصيرة، ولهذا اختفت من الأرض بالانحلال إلى عناصر أخرى. وقد شذ البلوتونيوم عن ذلك، فقد وجد العلماء كميات قليلة جدًا من نظير البلوتونيوم 244Pu في الأرض.
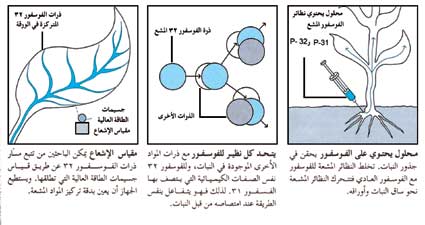 |
كيف تستخدم النظائر المشعة في الأبحاث الأحيائية تستخدم النظائر المشعة كعناصر استشفافية لتتبع العمليات البيولوجية وأنظمتها. وتبين هذه الرسوم كيف أن الفوسفور 32 قد تمت متابعته في أنسجة لنبات ما. |
استخدام النظائر المشعة:
للنظائر المشعة استخدامات مهمة في العلم والصناعة. ولأنها مشعة، فإن كشفها سهل، حتى ولو كانت بكميات صغيرة جدًا. فهي تتفق كيميائيًا مع بقية نظائر العنصر نفسه، وعليه يمكن أن تحل محل النظائر الشائعة في التفاعلات الكيميائية. ولذلك يمكن استخدامها في دراسة تفاصيل تفاعل كيميائي أو تفاعل حيوي. فالكيميائيون الحيويون مثلا، يستخدمون الكربون المشع في تتبع مسار ذرات الكربون في عملية التركيب الضوئي في النباتات الخضراء. وهم يكشفون الجسيمات والأشعة المنبعثة من الذرات المشعة بوساطة أجهزة مثل عداد جايجر، ومطياف أشعة جاما والعدادات النسبية.وتستخدم النظائر المشعة في الطب النووي على نطاق واسع، حيث تستخدم فيه المواد المشعة لدراسة وتشخيص وعلاج أمراض معينة. كذلك تستخدم النظائر المشعة في مختلف أنواع الدراسات البيئية وبخاصة الدراسات المهتمة بالإشعاع النووي.
هذا وغالبًا ما تستعمل النظائر المشعة في الصناعة في قياس سُمْك المواد، إذ تمتص الأشعة المنبعثة عن نظائر مشعة جزئيًا خلال مرورها عبر المواد. ثم تستخدم كشافات الأشعة في قياس كثافة الأشعة التي مرت عبر المواد. ويبين الاختلاف في كثافة الأشعة الفرق في شحن مادة هي قيد المعاينة.
★ تَصَفح أيضًا: العنصر الكيميائي ؛ الإشعاع ؛ اليورانيوم ؛ الكيمياء الإشعاعية.