المعدن ( Mineral )
☰ جدول المحتويات
 |
الصخور تتكون من المعادن. قطعة كبيرة من الجرانيت، تحتوي على قطع صغيرة من هورنبلند وفلسبار (سليكات الألومنيوم) ومرو وميكا. وتظهر هذه المعادن بصورة منفردة، كما يُرى في الصور (يسارًا). |
تتضمن المعادن مواد شائعة مثل الملح الصخري وجرافيت أقلام الرصاص، ومواد نادرة مثل الذهب والفضة والأحجار الكريمة. ويوجد ما يقرب من 3,000 نوع من المعادن، لكن الشائع منها نحو مائة فقط. ويبقى العثور على معظم المعادن الأخرى أصعب من العثور على الذهب.
ويستخدم الناس المعادن لصناعة عدد كبير من المنتجات. فعلى سبيل المثال، يُستخدم الجرافيت لأقلام الرصاص، وأقلام التلوين، ومسحوق التلك المُعطَّر يتم صنعه من التلك. وتتضمن المنتجات الأخرى المصنوعة من المعادن الإسمنت والمواد المُخصِّبة للزراعة والمواد الكيميائية للصناعة.
ويستخدم كثير من الناس مصطلح معدن لأي مادة مستخرجة من باطن الأرض مثل الفحم والنفط والغاز الطبيعي والرمل ـ مع أنها ليست معادن. وهناك مواد معينة في الغذاء والماء، مثل الكالسيوم والحديد والفوسفور، يُطلق عليها أيضًا معادن. لكن خبراء المعادن، والعلماء الذين يهتمون بدراسة المعادن، لا يعتبرون أيًا منها كذلك.
يستخدم خبراء المعادن مصطلح معدن ليشير إلى المادة التي تتمتع بالخواص الأربع التالية: 1- يوجد المعدن في الطبيعة. فالماس الطبيعي من المعادن، لكن الماس الصناعي لا يكون كذلك. 2- يتكون المعدن من مواد لم تكن حية أصلاً، فالفحم الحجري والنفط والغاز الطبيعي على سبيل المثال ليست معادن لأنها تكونت من بقايا الحيوانات والنباتات. 3- للمعدن التركيب الكيميائي نفسه أينما وجد. فالرمل مثلاً، ليس معدنًا لأن عينات الرمل المستخرجة من أماكن مختلفة في العادة لها تركيبات كيميائية مختلفة. 4- تترتب ذرات المعدن في نسق منتظم، وتكوِّن وحدات صلبة تسمى البلُّورات. فالكالسيوم والفوسفور الموجودان في الحليب ليسا معدنين لأنهما مذابان في سائل، وليسا متبلورين (أو بلوريين).
التعرف على المعادن
تختلف المعادن اختلافاًَ بينًا في مظهرها وملمسها. فبعض المعادن، مثل المرو والماس، لها سطوح شبه زجاجية تتلألأ بالألوان المختلفة، وأخرى تبدو معتمة، ودهنية الملمس. والمعادن الصلبة لها القدرة على خدش أو تثليم الزجاج. أما اللينة أو الرخوة منها، مثل التلك والجبس، فيمكن خدشها بوساطة ظفر الأصبع. وهناك أربع ميزات رئيسية للمعادن وهي: 1- البريق 2- التفلج (الانشقاق) 3- الصلابة 4- اللون.
 |
بعض المعادن |
البريق:
ربما يكون للمعدن بريق ـ سواء كان فلزًا أو لافلز. فالمعادن التي لها بريق فلزي تلمع مثل الفلز. وتتضمن مثل هذه المعادن الجالينا والذهب والإيلمنيت (خام من أكاسيد الحديد والتيتانيوم يوجد في الصخور البركانية). أما المعادن التي لها بريق غير فلزي فهي تتغير في مظهرها. فالمرو يبدو زجاجيًا والتلك له سطح لؤلؤي، وبعض أنواع كبريتيد الزئبقيك تظهر معتمة وشبيهة بالطين أو الطَفْل. كما يختلف بريق معدن ما، من عينة إلى أخرى. فبعض كبريتيد الزئبقيك مثلاً، له بريق فلزي لامع وليس بريقًا معتمًا.التفلج (الانشقاق):
هو تجزؤ المعدن إلى قطع صغيرة لها سطوح منبسطة. وتختلف المعادن في عدد اتجاهات التجزؤ، وفي الزوايا التي تنبسط بها سطوحها. فالمَيْكا تتجزأ باتجاه واحد وتُكوِّن رقائق رفيعة. والهاليت (الملح الصخري) له ثلاثة اتجاهات تشقق ويتكسر إلى مكعبات دقيقة. أما الماس فربما يتجزأ إلى أربعة اتجاهات مُكونًا هرمًا. والمعادن الأخرى، مثل المرو (الكوارتز)، لا تتجزأ بترتيب، لكنها تتجزأ إلى قطع صغيرة بسطوح غير منتظمة.الصلابة:
يتم اختبار صلابة المعدن عن طريق محاولة خدشه بمعدن آخر. فالمعدن الصلب يخدش المعدن اللين. ويستخدم خبراء المعادن مقياسًا للصلابة اعتمادًا على هذا المبدأ. وقد ابتكر الألماني فريدريك موهس ـ وهو من خبراء المعادن ـ مقياسًا عام 1822م. ويضم مقياس الصلابة وفقًا لموهس عشرة معادن من الأقل ليونة إلى الأكثر صلابة، رقمت من 1 إلى 10. وتقاس صلابة المعادن الأخرى بتعيين ما إذا كانت تخدش أو تنخدش بمعادن مقياس موهس. فالجالينا على سبيل المثال، تخدش الجبس (رقم2)، ولكن يتم خدشها بوساطة الكلسيت (رقم 3). وعليه تكون صلابة الجالينا 2,5- بالتقريب وسطًا بين صلابة كل من الجبس والكلسيت. وظفر أصبع الإنسان لها صلابة حوالي 2.اللون:
يعتمد لون بعض المعادن على المواد التي تتألف منها البلُّورات. فاللون الأسود للإيلمنيت، والأحمر بكبريتيد الزئبقيك واللون الأخضر لحجر السربنتاين (سليكات المغنسيوم الصخرية المائية) جميعها تُنتج من التركيب الكيميائي لهذه المعادن. أما المعادن الأخرى فتكتسب ألوانها من الشوائب الكيميائية الموجودة بها. فبلورات المرو النقي على سبيل المثال، لا لون لها. ولكن وجود كميات ضئيلة من مواد أخرى في بلُّورات المرو تستطيع أن تكسب المرو لونًا خفيفًا ورديًا أو أخضر، أو تجعله أحيانًا أسود. |
اختبارات التعرف الشائعة. يتم اختبار صلابة المعدن بخدشه بالمعادن الموجودة وفقًا لمقياس موهس، الموضح في الجدول. اختبار لون المسحوق (الصورة الوسطى) يخلف شريطًا أحمر. يحك الكاشف الفلز على خزف صيني خشن ويمسح الشريط بالأصبع. (إلى اليسار)، يتفلج الكلسيت إلى قوالب، في حين أن الميكا يتفلج إلى رقائق. |
اختبارات التعرف الأخرى:
ربما يتم التعرف على بعض المعادن بوساطة هيئتها أو مظهرها العام. فالذهب يوجد على هيئة شذرات، بينما يوجد الماس على هيئة بلُّورات. أما خام الملح فيمكن أن يوجد على هيئة حُبيبات أو مجموعات من البلورات أو على هيئة كتل كبيرة. كما يوجد أسبستوس السربنتاين على هيئة عروق أو ألياف. ويستطيع خبراء المعادن التعرف عليها بوساطة ملمسها أو مذاقها أو رائحتها. فالتلك والسربنتاين يتمتعان بملمس دُهني، أما الإبسومايت وخام الملح ملحية المذاق، بينما لكل من البوراكس والميلانترايت مذاق حُلْو. والكاولينيت ذو رائحة ترابية.ويستخدم اختبار لون مسحوق المعدن للتعرف على المعدن. فالمعدن يُحَك عبر صفيحة خزف صيني خشنة بيضاء. وهذا الحك يطحن قشرة من المعدن ويحوِّلها إلى مسحوق ناعم، ويُخَلِّف وراءه شريطًا ملونًا على الصفيحة. وفي الغالب فإن هذا الشريط اللوني لا يكون له نفس لون المعدن. فالهيماتيت ذو اللون البني المحمر أو الأسود يترك دائمًا بعد حكّه شريطًا أحمر. كما يخلِّف كبريتيد النحاس وهو معدن أصفر، شريطًا أسود مشوبًا بالخضرة.
وهناك الكثير من الاختبارات الكيميائية التي يمكن اتباعها للتعرف على المعادن. ويُجرى أحد أبسط هذه الاختبارات بصب محلول حمضي دافئ مخفف على عينة. فإذا فار الحمض، كانت العينة تنتمي إلى مجموعة من المعادن تسمى الكربونات. ومن الأمثلة على معادن هذه المجموعة، الكلسيت والأرجونيت والدولميت. وتحتوي هذه المعادن في بنائها على الكربون والأكسجين، إلى جانب ذرات كيميائية أخرى. وعند صب المحلول الحمضي، ينطلق غاز ثاني أكسيد الكربون على هيئة فقاعات في محلول الحمض. ويمكن عمل هذا الاختبار في المنزل، وذلك باستخدام الخل كحمض. وهناك اختبار آخر هو اختبار اللهب، حيث يتم طحن قطعة صغيرة من المعدن إلى مسحوق يوضع قرب قاعدة الثقوب الهوائية لموقد بنزن المشتعل، ومن ثم يحمل الهواء المسحوق أعلى إلى اللهب. ويكتسب اللهب بسبب المسحوق لونًا دالاً على المعدن.
داخل المعادن
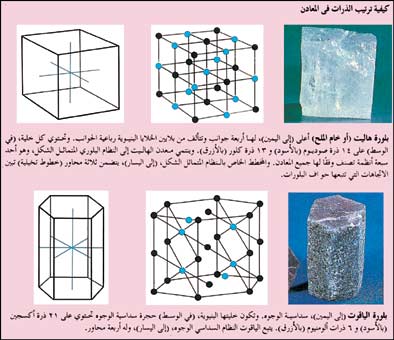 |
كيفية ترتيب الذرات في المعادن |
بلورات المعدن:
تبدو البلورات ذات أحجام مختلفة. فبلورة البريل الضخمة، (حجر كريم أخضر اللون) أو الفلسبار (سليكات الألومنيوم) ربما تزن أطنانًا بينما بلورة الكاولين (الطين) صغيرة جدًا، حتى أنه تصعب دراستها تحت المجهر. وبغض النظر عن الحجم، فكل البلورات هي في الأساس نفس الشيء. أي أن البلورات مجموعة من الذرات مرتبة في نموذج أو نمط منتظم.ولكي تتصور ما بداخل البلورة، عليك أن تتخيل الحُجُرات التي تتكون أو تنشأ من ذرات البلورة. فالحُجْرة في بلورة النحاس تتكون من 14 ذرة نحاس. هذه الحجرة لها ذرة عند كل زاوية من أرضيتها، وسقفها، وكل من جوانبها الأربعة. وبلُّورة النحاس تتألف من العديد من هذه الحُجْرات جنبًا إلى جنب. ومرصوصة إحداها فوق الأخرى. وتشارك الحجرات في ذرات النحاس في أماكن اصطفافها معًا. وخبراء المعادن يُسمون مثل هذه الحُجْرات خلايا بنيوية.
وتتألف معظم المعادن من نوعين أو أكثر من الذرات. على سبيل المثال، يتألف خام الملح من ذرات الصوديوم وذرات الكلور. وفي معادن أخرى قد يصل نوع الذرات إلى خمس ذرات مرتبة بعضها مع بعض بصورة معقدة. وبعض الخلايا البنيوية لها ستة جُدُُر بدلاً من أربعة، وبعضها له جُدُر مائلة. ويؤدي مثل هذا الاختلاف في شكل الخلايا البنيوية إلى اختلاف شكل بلورات المعدن.
الروابط الكيميائية:
هي قوى كهربائية تربط الذرات معًا في البلورة. ومن الروابط الكيميائية: الرابطة الأيونية التي تتكون من إعطاء ذرات معينة بعضًا من إلكتروناتها إلى ذرات أخرى. والرابطة الأيونية هي الرابطة الكيميائية الأكثر شيوعًا في المعادن. وتنشأ الروابط التساهمية من المشاركة الإلكترونية المتكافئة من الذرات. وهذه الروابط التساهمية قوية جدًا، وتوجد في معادن مثل الماس، وفي المركبات المحتوية على الكربون. وتضم الروابط الكيميائية ذرتين أو أكثر معًا في مواضع محددة فقط. وتعتمد هذه المواضع على حجم الذرات، وعلى عدد الإلكترونات الرابطة. أما شكل وحجم خلية الوحدة، فهو بدوره يعتمد على مواضع الذرات التي تأخذها عندما ترتبط بعضها مع بعض. ★ تَصَفح: الرابطة.لا تتكافأ قوة جميع الروابط بين الذرات. ويوضح هذا الاختلاف في قوة الرابطة تفلج بعض البلورات. وعليه فإن التفلج يحدث عندما تأخذ الروابط الضعيفة وضعًا على طول السطح يسمى مستوى التفلج أو الانشقاق. وعندما تقطع البلورة على طول هذا المستوى فإن الروابط الضعيفة تتكسر، وتبعًا لذلك تنشطر البلورة، كاشفة عن سطح مستو.
كيف تنمو المعادن:
تنمو معظم المعادن في السوائل. على سبيل المثال، تنمو بعض البلورات في سائل يسمى الصُهَارة عميقًا داخل الأرض. تحتوي هذه المادة الحارة جدًا على جميع أنواع الذرات التي تتألف منها المعادن الأرضية. وعندما تبرد الصُهَارة، فإن بعض الذرات ترتبط ببعض مكونة بلورات بالغة الصغر. تنمو هذه البلورات بإضافة طبقات من الذرات إلى سطوح البلورات الخارجية المنبسطة. والذرات الجديدة يجب أن تكون في الحجم المناسب، ويجب أن تملك العدد المناسب من الإلكترونات الرابطة حتى تتناسق وتتلاءم في البلورات النامية. |
لماذا تتفلج بعض المعادن |
مكونات المعدن وتركيبه:
تعد ذات أهمية في دراسة وتصنيف المعادن. فبعض المعادن لها نفس نوع البلُّورة، لكنها تختلف في ذرة أو أكثر من الذرات التي تؤلفها. فالأوليفين (الزبرجد الزيتوني) له بلُّورة أساسية مؤلفة من ذرات، ويمكن لكلٍّ من ذرات الحديد والمغنسيوم أن تتراص في هذه البلورة. ونتيجة لذلك فإن هناك نوعين من الأوليفين: الفورستيريت الذي يحتوي على ذرات المغنسيوم، والفاياليت المشتمل على ذرات الحديد. ويصف خبراء المعادن المعادن التي لها نفس التركيب ولكن مكوناتها مختلفة بأنها متماثلة شكليًا.وتتكون بعض بلُّورات المعادن من نفس نوع الذرات، لكنها تختلف في الطريقة التي تترتب بها الذرات بعضها مع بعض. على سبيل المثال، الماس والجرافيت كلاهما مؤلف من الكربون. ويترابط الكربون في الماس، وهو أصلب مادة معروفة ـ في شكل هيكل قوي . أما الكربون في الجرافيت فيرتبط في رقائق سهلة الكسر. ويستخدم خبراء المعادن مصطلح متعدد الأشكال لوصف المعادن التي لها نفس المكونات ولكنها ذات تراكيب مختلفة.
وتتضمن غالبية طوائف المعادن ـ اعتمادًا على المكونات والتركيب ـ العناصر والكبريتيدات والهاليدات والكربونات والكبريتات والأكاسيد والفوسفات والسليكات. وطائفة السليكات لها أهمية خاصة لأنها تؤلف نسبة 95% من المعادن ـ تبعًا للحجم ـ في قشرة الأرض الصلبة. وتُقسَّم مجموعات المعادن إلى فصائل اعتمادًا على التركيب الكيميائي لكل معدن. وهذه الفصائل بدورها، مكونة من مجموعات من المعادن لها نفس التركيب. وتقسم المجموعات أيضًا إلى أصناف.
نبذة تاريخية
الدراسات المبكرة:
كانت المعادن من بين المواد الأولى التي استعملها الإنسان وقام بوصفها. فالرسومات المصرية منذ خمسة آلاف سنة بيَّنت استخدام المعادن في الأسلحة والحُليّ وفي المناسبات والمراسم الدينية. وقد كتب الفيلسوف اليوناني ثيوفراستس مقالة قصيرة عن المعادن في حوالي عام 300 ق.م. كما كتب بليني، كبير علماء روما، عن المعادن والخامات والأحجار والجواهر، وذلك حوالي سنة 77م. وهناك كتابات أخرى عن المعادن تم إنجازها من قبل العلماء الألمان. وتتضمن هذه الكتابات كتابًا عن الفلزات لألبرتوس ماغنس (1262م) وكتابًا عن الفلزات لجورجيوس أجريكولا (1556م).الدراسات العلمية على بلورات المعادن:
بدأت في القرن السابع عشر الميلادي. ففي عام 1665م، أوضح العالم الإنجليزي روبرت هوك، أن الكرات المعدنية التي تتراكم بطرق مختلفة تأخذ شكل بلُّورات حجر الشب. وفي عام 1669م، وجد الطبيب الدنماركي نيكولاوس ستينو، أن الزوايا بين وجوه بلورات المرو تكون متطابقة رغم أن البلورات تأخذ أشكالاً مختلفة.وفي أواخر القرن الثامن عشر درس العلماء كثيرًا من المعادن. وتركز اهتمامهم على دراسة البنية الداخلية لبلورات هذه المعادن والأسباب التي تجعلها تتخذ أشكالاً مختلفة. وفي عام 1772م، ذهب العالم الفرنسي، روميه دولسيل إلى أن اكتشاف ستينو ـ السابق ذكره ـ يمكن تفسيره وقبوله فقط إذا كانت البلُّورات مؤلَّفة من وحدات متطابقة ومكدَّسة بعضها مع بعضً بطريقة منتظمة. وخلال ثمانينيات القرن الثامن عشر الميلادي اهتم العالم الفرنسي رينيه أويه بمتابعة الدراسة على هذه الوحدات المعدنية، وأطلق عليها اسم الجزيئات التكاملية. وفي ثمانينيات القرن الثامن عشر الميلادي بدأ الكيميائيون تطوير الأفكار والتصوّرات الواضحة عن طبيعة العناصر الكيميائية. لهذا تيقن خبراء المعادن آنذاك أن المعادن تتكون من مواد كيميائية، ولكن ما يزال تركيب المعادن غامضًا لديهم وغير مفهوم.
القرن العشرون:
خلال القرن العشرين، قَدَّمت دراسات الأشعة السينية الأساس لدراسة البنية الداخلية للمعادن. ففي عام 1912م، أرسل العالم الألماني، ماكس فون لو، حزمة صغيرة من الأشعة السينية على بلورة كبريتيد الزنك، إلا أن هذا الشعاع انكسر (انقسم) عبر السطوح المنبسطة للبلورة. وقد أظهرت هذه التجربة أن ذرات كبريتيد الزنك، مرتبطة معًا في رقائق يترابط بعضها مع بعض في زوايا معينة. ومن خلال تجارب مماثلة توصل العلماء مؤخرًا إلى معرفة كيفية ترتيب الذرات في الخلايا البنيوية، وكذلك إلى معرفة كيفية ترتيب هذه الخلايا بدورها، في البلورات. وفي ثلاثينيات القرن العشرين استخدم العلماء الأشعة السينية في دراسة ووصف كثير من المعادن المختلفة.وفي هذه الأيام أدى توافر الأجهزة المعملية إلى التغير المستمر في دراسة المعادن. فالمحلِّل الدقيق بالسَبْر الإلكتروني المتصل بالحاسوب، باستطاعته قياس تغيّرات المكونات الكيميائية لبلورة مفردة. أما مجهر المسح الإلكتروني فهو يكبر البلورات آلاف المرات مثل حجمها العادي. وقد استطاع العلماء تصوير انعكاسات الذرات والجزيئات وذلك باستخدام مجهر إلكتروني من نوع خاص. وبناء على ذلك أصبح بمقدور العلماء ملاحظة التركيب الداخلي لبلورة ما.
ولا تزال محاولات خبراء المعادن جادة للإجابة عن كثير من التساؤلات التي تتعلق بدراستها. فهم على سبيل المثال، يودون معرفة كيفية تكوّن معدن معين، ومعرفة لماذا تؤثر الشوائب على بلورات هذه المعادن وعلى خواصها الكهربائية. وفضلاً عن ذلك، فإن خبراء المعادن يكتشفون بشكل متواصل استخدامات جديدة للمعادن وللعناصر الكيميائية التي تحتوي عليها.
إختبر معلوماتك :
- لماذا يكون للمرو ألوان مختلفة؟
- ما المقصود بالخلية البنيوية؟
- ما المعدن الذي يتمتع بمذاق ملحي؟
- لماذا تتفلج المعادن إلى قطع صغيرة لها سطوح منبسطة؟
- لماذا لا يعتبر الماس الصناعي معدنًا؟
- ما الذي يربط الذرات بعضها مع بعض في بلورة ما؟
- ما نوع المعدن الذي يكون الكربونات؟ ولماذا يفور الحمض عند صبه على الكربونات؟
- كيف تنمو المعادن؟