البطارية ( Battery )
☰ جدول المحتويات
 |
البطاريات لها العديد من الاستعمالات. البطارية الصغيرة الحجم التي تشبه الزر في مقدمة الصورة، تغذّي ساعة المعصم بالطاقة.البطارية كبيرة الحجم في خلفية الصورة، تغذي السيارة بالطاقة اللازمة لإدارتها. |
تُستْخَدَم البطاريات بمثابة مصادر مريحة للطاقة الكهربائية. فهي تمد الأجهزة خفيفة الحمل مثل المذياع، والمسجلات الصوتية والتلفاز، بالطاقة الكهربائية. تمدّ البطارية السيارة بالطاقة الكهربائية اللازمة لإدارة المحرّك، كما تمدّ البطاريات أيضًا سفن الفضاء والغوَّاصات بالكهرباء. وخلال فترات انقطاع التيار، تمدّ البطاريات أجهزة الهاتف، وأجهزة إنذار الحرائق والمستشفيات وغيرها من المباني الأساسية بالكهرباء في حالات الطوارئ.
أنواع البطاريات
تنتج المصانع أنواعًا عديدة ومختلفة من البطاريات التي يمكن أن تُصنف حسب تصميماتها الأساسية. ويحدِّد تصميم البطارية كمية الكهرباء المولِّدة. وتتوقف بعض البطاريات التي تُسمى البطاريات الأولية عن العمل، وينتهي مفعولها، ويجب التخلص منها بعد استهلاك إحدى المواد الكيميائية المكونة لها. ويمكن إعادة استعمال أنواع أخرى من البطاريات بعد نفاد طاقتها وذلك بإعادة شحنها. ويسمى مثل هذا النوع البطاريات الثانوية، أو بطاريات التخزين.
يمكن أيضًا تصنيف البطاريات حسب محتوياتها الإلكتروليتية وهي المادة الموصلة للتيار الكهربائي داخل الخلية. وتحتوي العديد من أنواع البطاريات الأولية على الإكتروليت على هيئة مواد جيلاتينية، أو على هيئة مواد تشبه المعجون. وتُعرَف مثل هذه البطاريات التي تحتوي على مكوّنات غير قابلة للانسياب بالخلايا الجافة. وتسمى أنواع قليلة من البطاريات الأولية بالخلايا السائلة لاحتوائها على مواد كيميائية سائلة. وتحتوي أغلب أنواع البطاريات الثانوية على إلكتروليت سائل.
تُصنع البطاريات في أحجام متعددة. فمثلاً، البطاريات متناهية الصغر المستعملة في ساعات اليد الكهربائية تزن حوالي 1,4جم فقط. أما البطاريات الضخمة التي تغذي الغواصات بالطاقة فتزن مايصل إلى 0,91 طن متري. وعلى كلّ، فإن المنتجين يصنعون أغلب البطاريات في أحجام قياسية محددة. وعلى ذلك، يمكن استعمال البطاريات المنتجة من مصانع مختلفة في نفس الجهاز.
تختلف البطاريات أيضًا في الجهد المتولد. فالخلية الأولية كتلك المستعملة في كاشفات الضوء اليدوية جهدها 1,5 فولت. أما أغلب البطاريات الثانوية، والمستعملة في السيارات، فهي بطاريات جهدها 12 فولت، وهي تتكوّن من ست خلايا كل منها ينتج 2 فولت ومتصلة بعضها ببعض على التوالي.
كيف تعمل البطاريات الجافة الأولية
البطاريات الجافة الأولية هي أكثر أنواع الخلايا الجافة الأولية شيوعًا. تختلف هذه الأنواع من البطاريات في عديد من النواحي، ولكنّها تشترك جميعًا في مكوِّنات أساسية معيّنة. ويوجد في كلّ بطارية جافة أولية مكونان يسميان القطبين، ويتكون كل قطب من نوع مختلف من المواد الكيميائية الفعالة.
يتسبب الإلكتروليت الموجود بين الأقطاب في شحن أحدها وهو القطب السالب (المهبط) بشحنة سالبة، والآخر ويسمى القطب الموجب (المصعد أو الكاثود) بشحنة موجبة. ويساعد الإلكتروليت في استمرار تعزيز التفاعلات الكيميائية التي تحدث عند القطبين.
وهناك ثلاثة أنواع رئيسية من البطاريات الأولية الجافة، هي: 1ـ خلايا الكربون ـ الخارصين. 2ـ الخلايا القاعدية. 3ـ خلايا الزئبق.
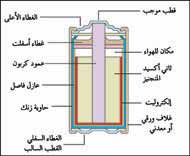 |
خلية جافة تتكون من عبوة من الزنك مملوءة بالمواد التي تولد تيارًا كهربائيًا نتيجة لتفاعل كيميائي بينها. يكون جدار العبوة نفسه القطب السالب للخلية. يعمل عمود الكربون عند المركز كقطب موجب. |
خلايا الكربون ـ الخارصين:
متعددة الاستعمالات، حيث تستعمل في كشَّافات الضوء اليدوية، ووحدات توليد الومضات الكهربائية لأجهزة وآلات التصوير، وفي لعب الأطفال. وتسمى هذه الخلايا أيضًا عمود لكلانشيه الجاف، وهي مُصممة داخل عبوة من الخارصين. وتستخدم العلبة كإناء لمحتويات الخلية، وفي الوقت نفسه تقوم بعمل القطب السالب. يعمل عمود الكربون الموجود في مركز الخلية، كمجمع تيار للقطب الموجب. إلا أن المادة الفعلية المكوّنة للقطب الموجب هي خليط من ثاني أكسيد المنجنيز ومسحوق الكربون، وهذا الخليط مضغوط حول العمود. ويوجد الإلكتروليت في هذه الخلايا في صورة معجون يتكوّن من كلوريد الأمونيوم وكلوريد الخارصين والماء.يفصل القطبان السالب والموجب بشريحة من مادة مساميّة مثل الورق أو الكربون التي سبق غمسها في الإلكتروليت. وتُسمى هذه الطبقة الرّقيقة العازل، وهي تمنع المواد المكونة للأقطاب من الاختلاط معًا أو التفاعل في حالة عدم استعمال البطارية. مثل هذا الاختلاط من شأنه أن يؤدي إلى تآكل القطب السّالب الخارصيني قبل الأوان، والتقليل من العمر الافتراضي للبطارية.
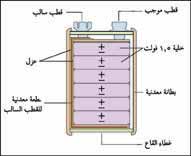 |
بطارية 9 فولت تتكون من ستة خلايا جافة، تولد كل خلية 1,5 فولت من الكهرباء. توصل الخلايا على التوالي الواحدة بالأخرى بحيث يكون الجهد النهائي المتولد 9 فولت. تزود مثل هذه البطاريات أجهزة ترانزستور الراديو بالطاقة. |
Zn¶ Zn ++ + 2é
تتحرّك أيونات الخارصين مبتعدة عن القطب السالب وبتحركها هذا تترك إلكتروناتها على سطح القطب السالب. وعلى هذا يكتسب القطب السالب عددًا كبيرًا من الإلكترونات ويصبح مشحونًا بشحنة سالبة أكثر من القطب الآخر.
وإذا ما وُصلت الخلية بدائرة خارجية، فإن الإلكترونات المتوافرة لدى قطب الخارصين تمرّ خلال الدائرة إلى عمود الكربون، وينتج عن حركة الإلكترونات هذه التيار الكهربائي. وبعد دخول الإلكترونات إلى الخلية عبر عمود الكربون، فإنها ترتبط مع بعض جزيئات ثاني أكسيد المنجنيز ¸MnO2· وجزئيات الماء ¸H2O·. وباختزال هذه المواد (اكتسابها للإلكترونات)، يتكوّن أكسيد المنجنيز (Mn2O3)، وأيونات الهيدوكسيد السالبة (OH -):
2MnO2 + H2O + 2e-¶ Mn2O3 + 2OH -
يمثِّل هذا التفاعل النصف الثاني لعملية استهلاك شحنة الخلية، ويكون مصحوبًا بتفاعل ثانوي. ترتبط أيونات الهيدوكسيد السالبة في هذا التفاعل الثانوي بأيونات الأمونيوم الموجبة (NH4+) التي تنتج عن إذابة كلوريد الأمونيوم ¸NH4Cl· في الماء. وينتج عن التفاعل الثانوي جزيئات من الأمونيا ¸NH3· (النشادر)، وجزيئات من الماء.
وتستمر التفاعلات الكيميائية المختلفة التي عن طريقها تولد خلية الكربون ـ الخارصين الكهرباء، حتى يُستهلك ثاني أكسيد المنجنيز، وبتآكل هذه المادة المكونة للقطب الموجب تكون الخلية قد استُهلكت بالفعل ولا يمكنها توليد طاقة فعّالة، وتكون بذلك قد خَبَتْ.
ويجب إزالة الخلايا المستهلكة فورًا من الأجهزة. فبعد أن تقف الخلية عن العمل، فإن الإلكتروليت بها يستمر في إحداث تآكل في جدارالعبوة ويتسبب في ثقبه ويؤدي تسرّب الإلكتروليت خارج البطارية إلى إتلاف الجهاز.
لا يمكن إعادة شحن خلية الكربون ـ الخارصين بفاعلية، شأنها في ذلك شأن غالبية البطاريات الأولية. وهناك جهاز يُسمى شاحن البطارية يمكن أن يطيل عمر الخلية لوقت محدود، فهو يؤدي جزئيًا إلى إعادة فاعلية الخلية لتوليد الكهرباء. يعمل شاحن البطارية على إمرار تيّار كهربائي خلال الخلية في اتجاه مضاد لمرور التيار خلال عملية التفريغ.
الخلايا القاعدية:
تشبه خلايا الكربون ـ الخارصين، ففي كليهما نجد نفس المواد المكوّنة للقطب السالب والقطب الموجب. تقوم هذه المواد بتفاعلات كيميائية متشابهة ؛ إلا أن هذين النوعين من الخلايا الأولية الجافة يختلفان في عديد من النواحي.تحتوي الخلية القاعدية على قطب سالب من الخارصين يغلب عليه التكوين المسامي الذي يتأكسد بدرجة أسرع من ذلك الموجود في خلية الكربون ـ الخارصين. والإلكتروليت في الخلية القاعدية عبارة عن محلول قلوي قوي يحتوي على مركب هيدروكسيد البوتاسيوم. ويوصل هذا المركب الكهرباء داخل الخلية بدرجة أكثر فاعلية من محلول كلوريد الأمونيوم، وكلوريد الخارصين في خلية الكربون ـ الخارصين. وتمكن هذه المواصفات الخلية القاعدية من توليد تيّار عالٍ يستمر بكفاءة أعلى من خليّة الكربون ـ الخارصين.
تستخدم الخلايا القاعدية مصدرًا ممتازًا للإضاءة في مصابيح الدراجات، وآلات الحلاقة، وأجهزة التلفاز خفيفة الحمل، وأجهزة التخاطب الإلكترونية. هذه الخلايا أكفأ اقتصاديًا في حالة استعمالها في لعب الأطفال الكهربائية التي تتطلب كمية عالية من الكهرباء، عن خلايا الكربون ـ الخارصين، وذلك لأن عمرها الافتراضي أطول بما يتراوح بين 5 و 8 مرات.
خلايا الزئبق:
ذات قطب سالب من الخارصين، وقطب موجب من أكسيد الزئبقيك، تحتوي على إلكتروليت هيدروكسيد البوتاسيوم. ويتحول الخارصين إلى أكسيد الخارصين ، ويتحوّل أكسيد الزئبقيك إلى زئبق خلال عملية الاستهلاك، كما يتبقَّى مركّب هيدروكسيد البوتاسيوم دون تغير.وتتميز خلية الزئبق بالعديد من المزايا عن كل ّ من خلية الكربون ـ الخارصين والخلية القاعدية. فمثلاً، يبقى جهد خلية الزئبق ثابتًا في حين أنّ الخلايا الأولية الأخرى ينخفض الجهد فيها خلال عملية الاستهلاك. وتجعل هذه الميزة خلايا الزئبق أكثر ملاءمة للأجهزة الحساسة مثل مساعدات السمع والأجهزة العلمية.
كيف تعمل البطاريات الثانوية
صُمِّمَت البطارية الثانوية بطريقة يمكن بها عكس التفاعلات الكيميائية إلى الاتجاه المضاد. وتُمْكِّن هذه الميزة من إعادة شحن البطارية بكفاءة بعد نفاد الطاقة الكهربائية التي يمكن توليدها. وأكثر أنواع البطاريات الثانوية شيوعًا هي:
1- بطاريات التخزين رصاص ـ حمض.
2- بطاريات التخزين نيكل ـ كادميوم.
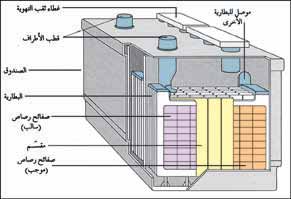 |
أجزاء بطارية تخزين الحمض والرصاص تحتوي غالبية بطاريات التخزين رصاص ـ حامض على ست خلايا تحتوي كل خلية على مجموعتين من أقطاب الرصاص تسمى الصفائح. تفصل الصفائح بعضها عن بعضها الآخر برقائق من البلاستيك أو المطاط. يحيط محلول من حامض الكبريتيك والمسمى |
بطاريات التخزين رصاص ـ حمض:
تتكون من إناء مصنوع من البلاستيك أو المطاط المقَوَّى، وتحتوي على 3 ـ 6 هياكل، وكلّ هيكل يحتوي على قطبين، كلّ قطب على هيكل شبكي أو على هيئة صفائح. الهيكل الخارجي لكلّ من هذه الأقطاب على شكل صفيحة معدنية مثقبة مصنَّعة من سبيكة الرصاص ـ الأنتيمون. تتم تعبئة ثقوب هذه الهياكل الشبكية للقطب السالب بكتل من الرصاص الإسفنجي النّقي، وهذه الثقوب توجد على مسافات متساويةكما في حالة المصفاة أو المنخل. تحتوي الثقوب الموجودة بالقطب الموجب، على ثاني أكسيد الرصاص، وهو مركب ناشئ عن ارتباط عنصري الرصاص والأكسجين يحيط الإلكتروليت الذي يتكوّن من حمض الكبريتيك والماء بالأقطاب.تتم التفاعلات الكيميائية خلال عملية التفريغ بين مكوِّنات القطبين والإلكتروليت. تتفاعل ذرات الرصاص النقية عند القطب السالب بأيونات الكبريتات السالبـة ¸SO4--· الموجودة في الإلكتروليت. تتكوّن كلّ من أيونات الكبريتات السالبة، وأيونات الهيدروجين الموجبة ¸H+·، عند إذابة حمض الكبريتيك في الماء. وبارتباط ذرات الرصاص بأيونات الكبريتات، تفقد كلّ ذرة رصاص اثنين من الإكترونات لتصبح جزئي كبريتات الرصاص ¸PbSO4·. وهذا يُمَثِّل التفاعل الكيميائي عند القطب السالب كالآتي:
Pb + SO4-- ¶ PbSO4 + 2é
تتدفق الإلكترونات التي تفقدها ذرات الرصاص من القطب السالب إلى القطب الموجب خلال الجهاز الذي يستهلك تيار الكهرباء. وتلتقط جزيئات ثاني أكسيد الرصاص الإلكترونات عند القطب الموجب والتي تتفاعل بالتالي مع أيونات الهيدروجين وأيونات الكبريتات الموجودة في الإلكتروليت. ينتج عن هذا التفاعل كلّ من كبريتات الرصاص والماء.
PbO2 + 4H+ + SO4-- + 2é ¶ PbSO4+2H2O
وبجمع كل من التفاعلات التي تحدث عند القطب الموجب والقطب السالب، يمكن تمثيل التفاعل العام الذي يحدث خلال استعمال البطارية:
Pb + PbO2 + 2H2SO4 ¶ 2PbSO4 + 2H2O
وعلى ذلك يستهلك حمض الكبريتيك، وينتج الماء أثناء استهلاك البطارية. وبالتدرج يصبح حمض الكبريتيك مخففًا بدرجة لا تسمح باستمرارية التفاعلات الكيميائية الضرورية.
ويمكن إعادة شحن البطارية باستعمال شاحن البطارية، وذلك عندما تفقد بطارية الرصاص ـ الحمض فعاليتها لتوليد الكهرباء.ويدفع شاحن البطارية الإلكترونات فتمرّ خلال البطارية في اتجاه مضاد لذلك الذي يتم خلال عملية التفريغ. ويؤدي هذا العمل إلى عكس التفاعلات الكيميائية التي تحدث أثناء عملية تفريغ البطارية.
وتؤدي هذه التفاعلات العكسية التي تتمّ عند الشحن، إلى إعادة المواد المكوّنة للأقطاب إلى تركيبها الأصلي. كما أنها تؤدي إلى زيادة كمية حمض الكبريتيك في الإلكتروليت إلى المستوى الضروري. ويمكن للبطارية توليد الكهرباء مرّة ثانية وذلك بعد إعادة شحنها.
تمدّ بطاريات الرصاص ـ الحمض الأجهزة الكهربائية لكلّ من السيارات والشاحنات بالطاقة. كما أنها تمد الغواصات بالطاقة، وتمد أيضًا كلاً من المستشفيات ومحطات معالجة الصرف الصحي، بالكهرباء في أوقات الطوارئ.
بطاريات التخزين نيكل ـ كادميوم:
تعمل بنفس الأسس العامة كبطاريات الرصاص ـ الحمض، ولكن تستعمل فيها مواد كيميائية مختلفة. يصنع القطب السالب في بطارية النيكل ـ الكادميوم، من الكادميوم، كما أن القطب الموجب يتكوّن من أكسيد النيكل، ويستعمل محلول هيدروكسيد البوتاسيوم كإلكتروليت.يُصَمَّم التكوين الكيميائي لبطارية النيكل ـ كادميوم بحيث يكون الإناء المحتوي على مكونات البطارية محكمًا ضد الهواء، مما يمنع الإلكتروليت ذا الطبيعة التآكلية ـ من التسرب إلى الخارج. ولهذه الميزة تستعمل بطاريات النيكل ـ كادميوم في آلات الحفر، وآلات الحدائق، وغيرها من الأجهزة خفيفة الحمل. وتستعمل هذه البطاريات في أغلب أنواع الأقمار الصناعية.
نبذة تاريخية
من المحتمل أن يكون العالم الإيطالي كونت أليسنادرو فولتا أول من صمّم بطارية عملية وذلك في أواخر التسعينيات من القرن الثامن عشر الميلادي، وعُرِفَ اختراع فولتا بالعمود (المركم) الفولتي. تتكون هذه البطارية من طبقات، كلّ طبقة تحتوي على أزواج كلّ من أقر اص الفضة وأقراص الخارصين، ويَفْصل كلاًّ منهما عن الآخر شرائح من الورق المقوى مبللة بمحلول ملحي.
صمَّم الكيميائي الإنجليزي جون. ف. دانيال عام 1836م خلية أولية أكثر كفاءة. تحتوي خلية دانيال على محلولين للإلكتروليت، تستطيع توليد تيار أكثر ثباتًا من تصميم فولتا. وفي عام 1859م، اخترع عالم الطبيعيات الفرنسي جاستون بلانت أوّل بطارية ثانوية، وهي خلية التخزين الرصاص ـ حمض. وخلال الستينيات من القرن التاسع عشر، اخترع عالم فرنسي آخر هو جورج لكلانشيه نوعًا من الخلايا الأولية التي طُورت منها الخلايا الجافة المستعملة حاليًّا.
صمم العلماء، عبر السنين، بطاريات أصغر حجمًا وأكثر قدرة للأعداد المتزايدة من الأجهزة الكهربائية المحمولة، وعلى سبيل المثال، فإن خلية بطارية الليثيوم متناهية في الصغر لدرجة أنها غالبًا ما تُسمى ببطارية الزر، وهي تستطيع توليد جهد أعلى من أية خلية منفردة أخرى. يُسْتَعمل في هذه البطارية، معدن الليثيوم بوصفه قطبًا سالبًا. أما القطب الموجب، فيمكن أن يُصْنَع من واحد من العديد من المركّبات المؤكسدة. تستعمل خلايا الليثيوم غالبًا في الحاسبات الإلكترونية، وآلات التصوير، ومنظّمات ضربات القلب، والساعات.
صمّم الباحثون أيضًا بطارية التخزين الرصاص ـ حمض التي لا تحتاج إلى إضافة الماء من وقت لآخر تُسمى هذه البطارية البطارية التي لا تحتاج لصيانة، وهي محكمة الإغلاق تمامًا فيما عدا صمّام أمان لتسريب الغازات إلى الخارج. هذه البطارية لها عمر افتراضي أطول من البطارية القياسية رصاص ـ حمض، ذلك لأن أقطابها المزجزجة مُصَنَّعة من سبائك الرصاص ـ كالسيوم ـ قصدير. هذه المواد لا تتسبّب في تفريغ البطارية في حالة عدم استعمالها كما هو الحال في البطاريات التي تستعمل فيها سبائك الرصاص ـ أنتيمون.
★ تَصَفح أيضًا: الدائرة الكهربائية ؛ الكهرباء ؛ الكيمياء الكهربائية ؛ التحليل الكهربائي ؛ خلية الوقود.